研究紹介
マウス生殖細胞/生殖腺の発生、性分化および精子発生の分子機構の解明
高等動物の器官形成は、発生過程の特定の場所に固有の形態形成と細胞分化を指定する“マスター遺伝子”により制御される。 マスター遺伝子は、器官形成の一連のプログラムの最初のスイッチを押すことにより、下流の様々な転写因子・シグナル因子が時空間的に順序正しく発現・作用し、 その結果、予定領域から器官が誘導される(図1)。 マウスの生殖原基は、妊娠10.5日齢頃から、前後軸に沿って細長い(身体の1/3ほど)隆起として同定され、 妊娠11.5日齢頃には、機能・代謝レベルでも二つの異なった器官である精巣・卵巣への分化を開始する。 この性腺の雌雄のスイッチは、Y染色体上のHMG box型の転写因子であるSRYが、性腺の支持前駆細胞 (将来、雄ではセルトリ細胞、雌では顆粒層細胞)において作用するかどうかより決定される。 そのため、性決定は、細胞から器官レベルで、どのように時空間的に器官の運命決定を制御するのかを明らかにするのに非常に適した系であると考えている。
◯主な研究成果(クリックすると各項目のトップに移動します)
- 哺乳類の時間/空間的な性決定機構の解明
- 哺乳類の性腺のニッチ形成能の性差の分子基盤の解明
- 哺乳類の卵巣の自然発症的な雄性化の分子基盤
- 哺乳類の進化的に保存された精原幹細胞ニッチの分子基盤
- マウスの卵巣発生での顆粒膜細胞の性的可塑性
- 精細管内のluminal flowを支えるセルトリバルブ(SV)と精子形成の品質保証
1. 哺乳類の時間/空間的な性決定機構の解明
特定領域研究 (計画研究), H16-20年度 哺乳類における時間/空間的性決定機構の解明本研究課題により、新たにSry機能解析用のモデル動物の樹立を目的とし、H16-18年度においてマウスHsp70プロモーターにSryを連結した 発現ベクターを用いて、Sry発現様式を改変したトランスジェニック(Tg)マウスの樹立を行った。 その結果、ステージ・領域非特異的かつ恒常的にSry発現するXX精巣の性転換ライン(#40、#46)2系統を樹立した (Kidokoro et al., Dev Biol,2005)。 さらに、通常飼育下で繁殖能があり(XX卵巣)、人為的に熱ショック(HS)を与えることにより、卵巣からXX精巣へと性転換させることができる Sry誘導モデルマウス(#44)の樹立に初めて成功した(図2) (Hiramatsu et al., Development, 2009 ; see Research Highlights in Nature 456, 678, 2008)。
本モデルマウスを用いて、以下の点を明らかにした。
1) XX個体において、Sry単独では完全な精子形成能を持つセルトリ細胞に分化できず、SRY以外のY染色体上の遺伝子が必須であること(図3). (Ishii, Tachiwana, Hoshino et al., Development, 2007)
2) 性分化初期(11.0-11.25dpc)でのSry発現が精巣決定に必須 であり(精巣誘導の臨界期の決定)、この6時間のSry作用が、性腺内のFgf9/Wnt4の発現バランスを雄型に誘導するに重要であること (図4). (Hiramatsu et al., Development, 2009)
3) Sry作用の直下にグルコース代謝制御の精巣特異的な分子カスケードが存在し、このカスケードにより雄特異的なSOX9高発現と形態形成のエネルギーを供給すること(図5). (Matoba et al., J Cell Sci, 2005; Matoba et al., Dev Biol, 2008)
4) XX性腺でSry誘導により6時間以内に発現誘導されるSRY直下の複数の複数の代謝関連因子群の同定.
これの成果は、哺乳類の性決定の仕組みの解明と精巣形成の時空間的な分子機序の深い理解に繋がり、 ヒトの様々な性分化異常症の理解と治療への応用へ直結するものと考えられます。
(他の関連研究の成果:Noma et al., Mech Dev, 2002 ; Hiramatsu et al., Dev Dyn, 2003 ; Sato et al., Reproduction, 2004 ; Ishii et al., Anat Embryol, 2005 ; Mizukami et al., Mol Reprod Dev, 2008)
2. 哺乳類の性腺のニッチ形成能の性差の分子基盤の解明
新学術領域研究 (公募研究), H21-22年度 マウス支持細胞のニッチ形成能の性的可塑性配偶子幹細胞の自己複製と分化は、性腺内の幹細胞を支持する特別な支持細胞(ニッチ細胞)とその周囲の微小環境(ニッチの場)の制御により維持されている。 哺乳類をのぞく多くの動物において、雌雄の性腺は、GSC(配偶子幹細胞) ニッチ(微小環境)を形成し、精巣同様に、卵巣においても出生後に卵子形成を行う。 一方、ヒト、マウスでは、雄にのみGSCが存在し、セルトリ細胞(雌では、卵胞上皮細胞に相当)のみが、ニッチ細胞として機能する。 我々は、XX/Sry性転換マウス精巣への雄(XY)GSCの移植により、核型がXXの支持細胞であってもニッチ形成は正常に誘導され、半数体形成まで支持できることを見出している (Ishii et al., Development, 2007)。 この結果は、支持細胞のニッチ形成能がSryの下流の一連の性分化プログラムに制御されていることを意味する。 まず、我々は、本研究課題により、哺乳類の性分化カスケードにおける支持細胞のニッチ形成因子の分子基盤を明確にすることを目的とし、以下の研究を行っている。
1) 哺乳類の精細管(ニッチの場の基本構造)の時空間的な形成機序の解明
ヒトを含めた哺乳類では、オスのみに配偶子幹細胞GSCが存在し、オスのみでみられるセルトリ細胞がニッチの場を提供します。 そのため、性腺のGSCを維持するニッチ形成能は、Y染色体上の精巣決定遺伝子Sryの下流のプログラムで制御されています。 マウスでは、ニッチの場の基礎となる精細管の構築も、胎生期のSry発現開始後すぐに(約36時間)誘導され、形態的に精巣へと分化します(図A)。 また、ヒト、マウスなどの胎生期の性腺の特徴は、前後軸に沿って非常に細長い構造をとることにあります。 このユニークな形は、腸間膜中に散在している移動中の始原生殖細胞(PGCs)を性腺内に効率よく取り込むのに有利な構造といえます。 しかし、その一方で、細長い構造が一因で、Sryの発現は原基全体で同時に開始せず、胎齢11.0日頃より中央部から前・後端に向かって徐々に波及し、 両端まで達した後、前端から後端に向けてその発現が消失するといった波状の一過性の発現パターンをとります(図Aの斜線)。 このSryのユニークな発現により、精巣化プログラムの開始時期が、中央部と後端部において6時間以上の時差が生まれますが、 すぐ後の精細管の構築の開始は、前後軸に沿って同調的に誘導されることが分かっています。 我々は以下のように性分化初期の性腺の領域差の存在と精巣化のプログラムの進行を同調化する因子として、FGF9、 FGF10を同定しました。
1: 性分化初期において、性腺の中央部の存在が、前・後端でのセルトリ細胞分化因子であるSOX9の発現維持と精細管形成に必須である。
2: 中央部からの前・後端での精細管誘導能は、中央部領域から分泌される液性因子が寄与し、その液性因子の本体がFGF9である。
3: 性分化期において、FGF9は、雄特異的に中央部で高い発現を維持し、その発現開始直後に下流シグナルの活性化が性腺全体に波及する。
4: FGF10も精巣特異的に中央部から発現し、精巣誘導においてFGF9と相補的に機能し得る。
5: FGFシグナルを抑制した場合、セルトリ細胞/精細管の形成は前・後端へと波及せず、中央部は精巣、前・後端部では卵巣構造(卵精巣)を示す。
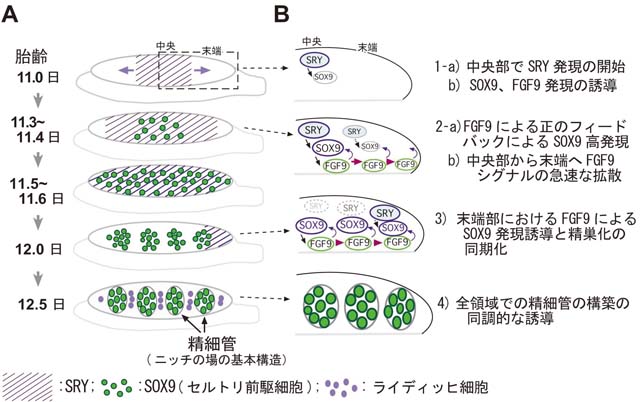
以上の結果は、性腺には前後軸に沿って機能的な領域差が存在し、中央部が両端部の精巣化を促進していることを初めて示したものです。 さらに、性腺の精巣化の同調性については、SOX9発現の正のフィードバック因子として機能するFGF9が、性腺の中央部から分泌され、 原基全体に末端まで急速に拡散します。これにより、セルトリ前駆細胞の分化の進行速度が末端部で早まり、 原基全体でニッチの場である精細管の形成が同期化して進行することが示唆されました。 本結果は、性腺全体のニッチの場となる精細管の構築を素早く行う時空間的な制御機序の一端を解明したと考えています。 (Hiramatsu et al., Development, 2010)。
2) マウス、ハムスター精巣での精細管の基底区画のグリア細胞由来神経栄養因子(GDNF; 精原幹細胞SSCの主要ニッチ因子の1つ) の可視化に成功
哺乳類の精巣では、恒常的に精子が産生され続けることで生命を次世代へ繋ぐ。 この恒常的な精子産生は、精細管の基底区画に存在する精原幹細胞SSCの自己複製により支えられている。 精原幹細胞SSCは、主にAs (A single)と2個の連結したAp (A paired)のGFRα1陽性の未分化型精原細胞集団の一部で構成されている(図B,赤)。 さらに未分化型精原細胞は、互いに連結した不完全分裂を繰り返すことにより4つ以上(A4, A8, A16など)のAalである分化型精祖細胞となり、 その後、精巣関門を通過し、減数分裂(精母細胞)を経て精子形成に至る(破線矢印,図B)。
SSCの自己複製は、GFRα1のリガンドであるGDNF(glial cell line derived neurotrophic factor)により制御されている。 このGDNF因子は、セルトリ細胞から基底区画に分泌され、基底区画内のSSCは、GFRα1(GDNF受容体)を介して自己複製が促進されるものと想定されている。 しかし、分泌されたGDNF因子が、いつ、どこで、どのようにGFRα1陽性のSSCに作用するのかは不明であった。 我々は、周年繁殖であるマウスと季節繁殖であるハムスターの精巣の精細管を用いて、透過処理を一切施さない全載標本による免疫染色法を開発し、 基底区画の細胞間隙に存在するGDNF因子の可視化に成功した。
非透過処理による全載染色の結果、1:ハムスター精細管内の基底区画では、性上皮周期に依存して精細管の半分程度の領域が陰性で、 GDNF陽性領域は、パッチ状で、顆粒状のGDNFの分布パターンを示した. 一方,マウスのGDNFの分布は、恒常的で、周期性に乏しいことが判明した(図A, 緑)。 2.両動物ともに、GDNFの局在の大部分は、c-kit陽性の分化型の精祖細胞との細胞間隙に認められた(筋様細胞周囲にも一部検出)(図B, 緑)。 3. ハムスターでは、大多数のGFRα1陽性の精原細胞の周囲でもGDNFが検出できず、ほんの一部のGFRα1陽性細胞しかGDNFと共局在していないことが判明した。
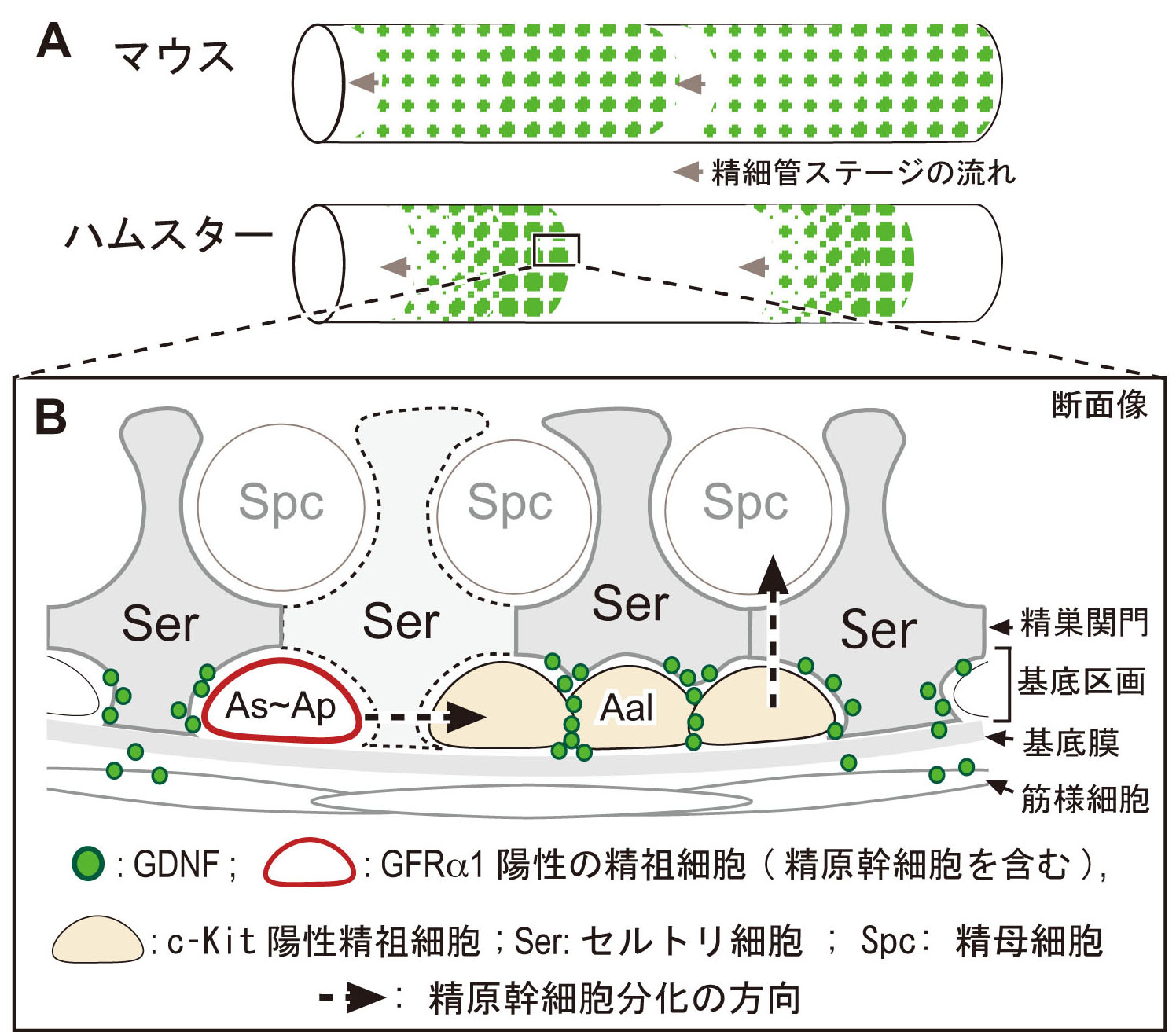
本結果は、ハムスターでは、基底区画内における局所的なGDNFの蓄積は、非常に局所的であり、 従来考えられていたような静的で安定したものではなく、c-kit陽性の分化型の精祖細胞の表面の一部にトラップされた状態で存在し、 性上皮の周期の動態に伴い絶えず変化していることが想定された。 また、本成果の一部は、マウスとハムスターでのGDNFの局在とGFRα1陽性の精原細胞の分布パターンの種差を初めて明らかにしたものでもあり、 周年繁殖と季節繁殖での精原幹細胞のニッチシステムの違いの理解にも大きく繋がるものと期待された。 (Sato, Aiyama, Inagaki-Ishii et al., PLoS one, 2011)
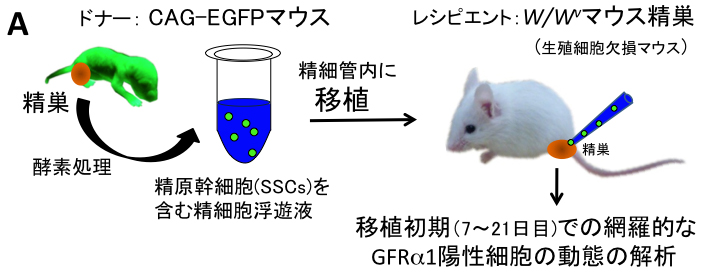
3) W/Wv マウス精巣への精原幹細胞移植における精原幹細胞の増殖パターンの解明
精原幹細胞SSCsは、GDNF因子により各SSC表面のGFRα1(GDNF受容体)を介して自己複製を促進すると考えられています。 しかし,実際にGFRα1陽性細胞のプールの中で、どの細胞が本当のSSCなのか? どのように増殖するのか? どのような細胞形態を示すのか? etc,,, 残念ながら、全く明らかになっていないのが現状です。これは、SSCs の同定法と定量法が、W/Wv(生殖細胞を欠く)マウスなどへの精原幹細胞移植法による 定着した精子形成コロニーの有無と、1精巣当たりのコロニー数にのみ依存していることが大きな原因となっています。 一方、肝心な精原幹細胞移植法でのコロニーの初期形成の過程で、実際に移植された一つのSSCがどのように増殖するのか? どのようなクローンが生き残り、どのクローンが死滅するのか? etc,,,についても明らかではなく、 移植初期の(SSCを含む)GFRα1陽性細胞の初期動態ですら未だ明らかでないのが現状です。 そこで、我々は,今回、初めて精原幹細胞移植の初期過程でのGFRα1陽性の未分化精原細胞の増殖パターンとその定着領域でのGDNF因子の発現パターンについて、 以下(図A,B)のように明らかにしました。
方法は、 W/Wvマウスの精細管中にGFP標識のSSCsを含む未分化精細胞を移植し、 移植初期(7~21日目)のGFP陽性細胞を含む精細管断片を蛍光実態顕微鏡下で網羅的に回収しました(図A)。 これらの回収した全載標本を網羅的にGFRα1の免疫染色を施し、 経時的に 1) 1精巣当たりのGFP陽性細胞コロニー(塊)の数、 2) 全GFP陽性コロニーでのGFRα1陽性細胞を含むコロニーの生存比率、 3) 1コロニー当たりのGFRα1陽性細胞数の比率を算出し、将来まで生存すると想定されたコロニー内のGFRα1陽性細胞(SSC)の動態を定量的に解析しました(図A)
精子発生が進行している正常な精細管では、As,Apの伸展したGFRα1陽性細胞を形成し、Aal4以降では,その大部分がGFRα1陰性となり、 精子への分化が進行することが明らかとなっています(赤;Bの上図)。 移植初期の定量的な解析の結果、1)初期の各コロニーの臨界期である、移植10~14日目でダイナミックな選択が起こり、 移植14日目までに、GFRα1陽性細胞を含むコロニーが生存/死滅するかの選択がなされること、 2)驚くべき事に、精細管移植でのGFRa1陽性細胞は、この臨界期である14日目まで、 複数の球状かつ桑実様の細胞集塊を形成してAal8, Aal16まで自己複製していること、 3)生存すると想定されるコロニーにおいて、1つのコロニー中で複数の桑実様のGFRα1陽性細胞塊を形成することetc,,, 面白い観察結果の一端が明らかとなってきました(赤;Bの下図)。 さらに、4)GDNF発現パターンを解析した結果,生殖細胞を欠くセルトリ細胞では高いGDNF発現を示し、 定着したコロニー形成の伸展に伴って領域特異的にGDNF発現が低下することも明らかとなりました(茶丸;図B)。
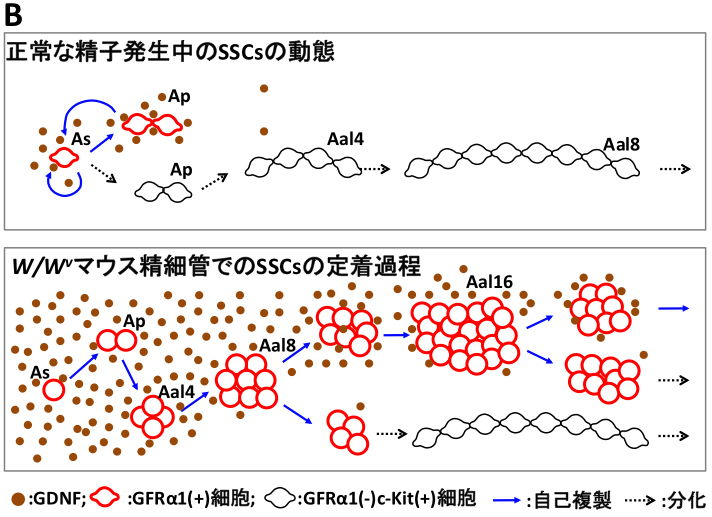
本結果は,移植下でのSSCsの動態は、通常の健康的な精子形成状態とは異なり, 1つのコロニー (1つのSSCから増殖したもの)中に複数の桑実様のGFRα1陽性細胞塊(SSC塊)を形成し、 定着の進行に伴いGDNFの発現量の低下によりコロニーが分化方向へとバランスが傾き、 移植14日目までに各コロニーの生存の有無が個別に選択されていることが示唆されました。 本成果は、精原幹細胞移植での一つのSSCの動態を初めて明らかにした基礎研究に留まらず、精原幹細胞移植において、 移植後14日目でのコロニー計測で十分であることが示唆され(今まで一ヶ月以上の移植後の待ち時間が必要)、 より敏速な精原幹細胞定量法への応用研究にも繋がるものと確信しています。 (Nagai, Shinomura et al., Developmental Dynamics, 2012)
3. 哺乳類の卵巣の自然発症的な雄性化の分子基盤
新学術領域研究 (公募研究), H23-26年度 性差構築の分子基盤1) マウス卵巣の性的未分化な顆粒層細胞 (卵胞膜細胞) の発見
ヒトを含め哺乳類の性腺は、性的に未分化な状態 (精巣・卵巣の両性に分化可能な状態)で発生します。XY(遺伝的に雄)個体では、Y染色 体上の精巣決定因子SRYの働きによりSOX9(精巣形成のマスター転写因子)の発現が 'on'になり、精巣(睾丸)を形成します。一方、XX 個体では、SRYが働かずSOX9の発現が 'off'状態で維持され、その後、FOXL2などの卵巣因子群が 'on' になり、卵巣を形成します。し かし、「いつ、どこで、どのように」性的に未分化な性腺が卵巣へと分化するかは、未だに明らかにされていませんでした。
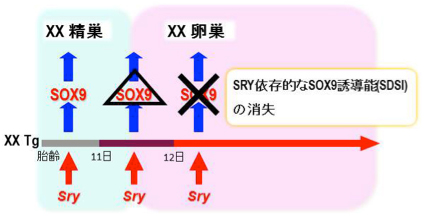
我々は、人為的な熱ショック(HS, 43℃, 10 min)によりSRYを誘導できるHSP-Sry Tg マウス系統を樹立しています (Hiramatsu et al. , Development, 2009)。このHsp-SRY Tg 性腺では、性分化初期にHS処理をすると、SRY依存的にSOX9の発現を誘導し、XX精巣へと性転換し ます。しかし、性分化後期では、性腺自体のSRY依存的なSOX9の誘導能(SDSI)が消失し、SRYを発現させても性転換せず、XX卵巣になるこ とが分かっています (上図)。今回、私たちは、 (1) このSDSI活性が、XX性腺の体細胞の性的未分化な状態の重要な指標であること、(2) XX性腺の性分化過程でのSDSI活性の消失は、卵巣化の最初の一歩であることが強く示唆されました。さらに、マウスの一生を通して、卵 巣組織内でのSDSI活性を解析した結果、(3) 性分化初期からSDSIを維持した(性的未分化な)細胞(顆粒層細胞の一種)を思春期 (マウス で21日齢前後)まで維持していることを初めて見出しました(下図)。この性的未分化な顆粒層細胞の動態をXX性分化疾患モデル下で解析し た結果、(4)この性的未分化な顆粒層細胞は、XX卵精巣における病巣 (精巣領域) の形成に深く寄与していることも明らかとなりました。
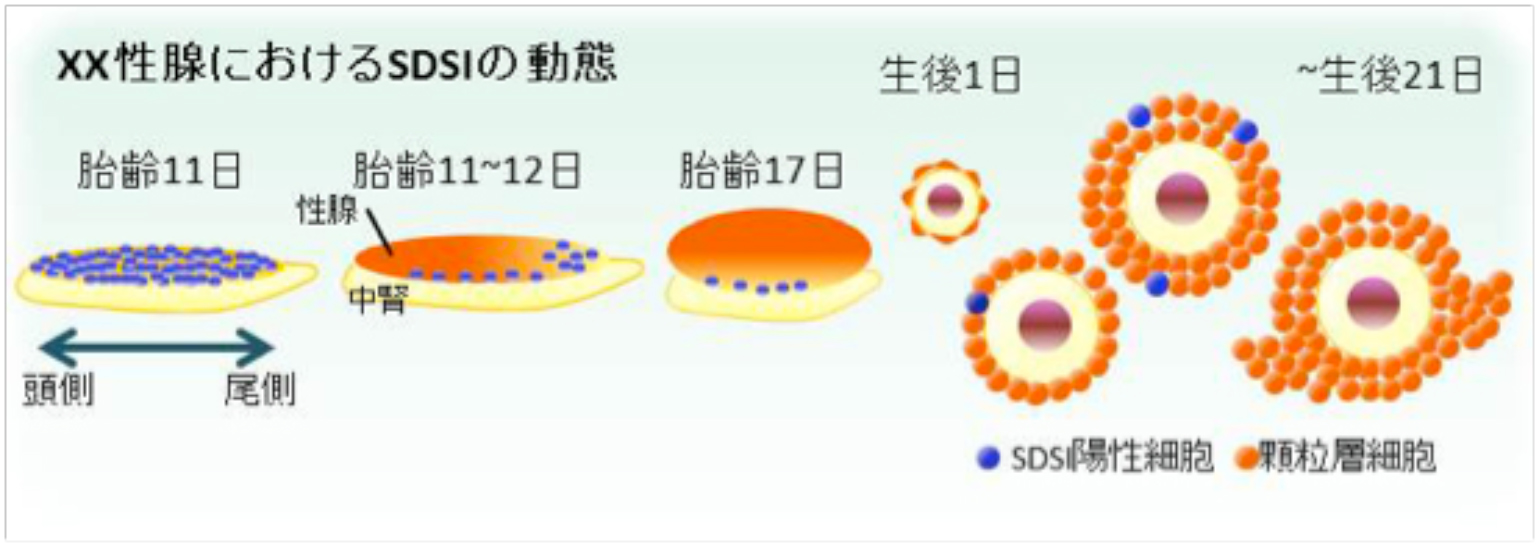
私たちは、哺乳類の性腺体細胞の性的に未分化な状態の動態を、世界に先駆けて初めて可視化することに成功しました。本成果は,少 なくとも思春期に至るまで、卵巣組織内に性的未分化性な顆粒層細胞の一種が維持されており、XX精巣化の大きな一因となっている可能 性を突き止めました。この性的未分化な顆粒層細胞の発見は、ヒトにおける46,XX性分化疾患の病態解明だけでなく、思春期に抱える様々 な卵巣疾患の病因の深い理解に大きく貢献をするものと考えています。 (Harikae et al., J. Cell Sci., 2013)
2) AMH-TRECKによるセルトリ細胞移植・置換技術の開発
性決定の主役を担う支持細胞(♂:精細管のセルトリ細胞、♀:卵胞の顆粒膜細胞)は、精子・卵子の形成を育む環境を作るのに重要な 体細胞群です。「性分化異常,性転換したセルトリ様の細胞が、精原幹細胞の維持・精子発生をどの程度までサポートできるのか?」 を評 価することは今まで非常に困難でした。この成体セルトリ細胞の機能的な評価法の1つとして、セルトリ細胞移植が挙げられます。しかし 、哺乳類の精巣でセルトリ細胞を移植・置換でする技術は未だに確立されていませんでした。
成体で特定の細胞を特異的に除去する手法として、TRECK(Toxin receptor-mediated conditional knockout)法が知られています(Sait o et al., Nature Biotech, 2001)。ジフテリア毒素(DT)に対して非感受性であるマウスの組織に毒素受容体(DTR)を発現させたトランスジ ェニック(Tg)マウスを作成し、時期特異的に毒素投与により標的細胞を破壊する方法です。また、抗ミュラー管ホルモン(AMH)は、性腺の セルトリ細胞、顆粒膜細胞に特異的に発現しており、AMH遺伝子のプロモーターを利用することにより、セルトリ細胞・顆粒膜細胞に特異的 に外来性の遺伝子を強制発現させることができます。今回、私たちは、AMHプロモーターとTRECK法を組み合わせ、性腺の支持細胞に特異的 に毒素受容体を発現させたAMH-TRECKマウス系統を樹立しました(図参照)。
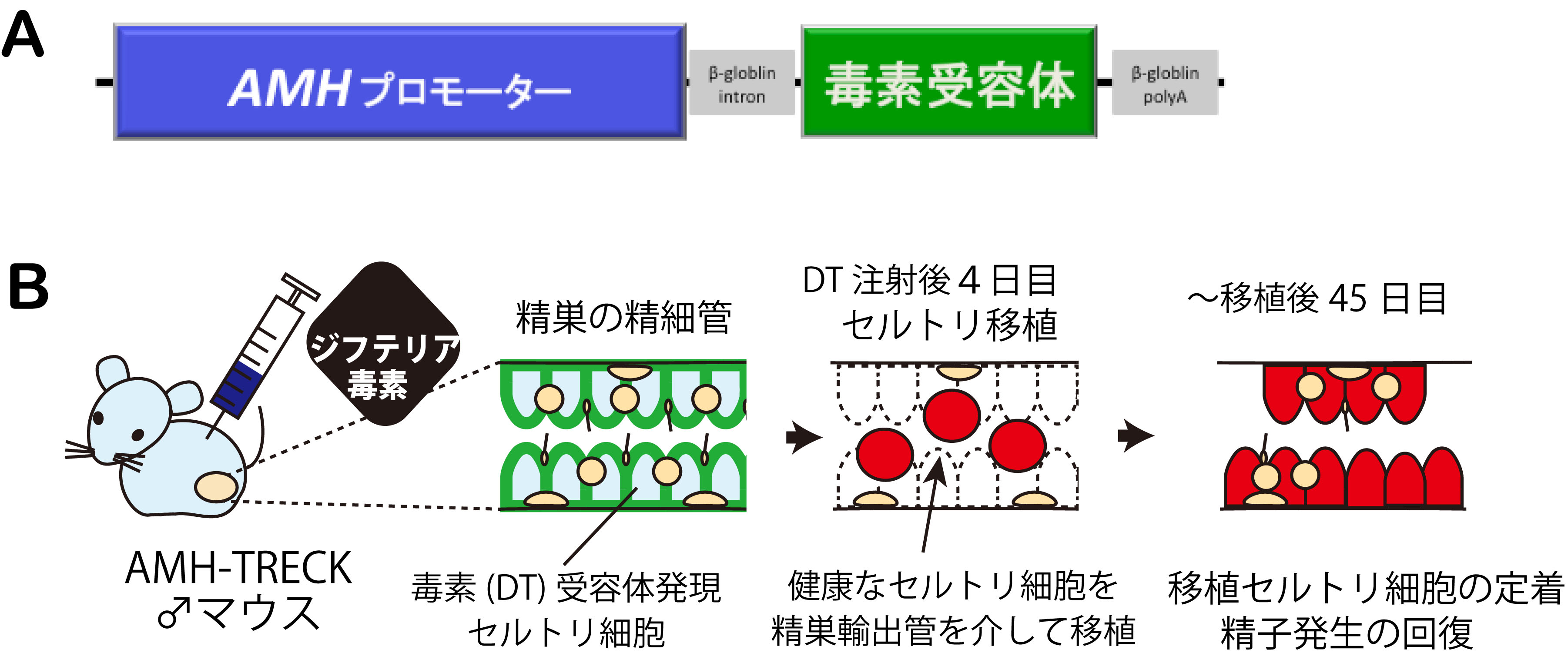
今回、樹立したAMH-TRECKマウスは、セルトリ細胞および顆粒層細胞のみにDT受容体が発現し、個体にDTを投与によりセルトリ細胞・顆 粒膜細胞のみを特異的に除去できます。DT処理によりセルトリ細胞の除去後、支えを失った生殖細胞は4日目までに死に始め、1週目には 、全てのセルトリ細胞、精細胞は死滅し、石灰化を伴い精巣構造は消失します。私たちは、このDT処理後4日目の精巣に、別個体の健康な セルトリ細胞を移植しました。その結果、移植後数日以内に、移植セルトリ細胞は精細管に定着し,宿主の精細胞を支持することが判明しま した。さらに、移植後一ヶ月半までには、移植セルトリ細胞は伸長型精子細胞を含む精子形成をサポートし、精子形成の部分的な回復が認 められました。 本成果は、AMH-TRECKマウスを用いることによりセルトリ細胞を高効率に移植?置換することが可能となり、移植セルトリ 細胞による宿主由来の精細胞の精子形成を回復することに初めて成功しました。現在、AMH-TRECK/免疫不全背景のマウス系統を利用し、家 畜セルトリ移植法による家畜精子の恒常的な生産技術(代理種雄マウス)の開発を進めています (Shinomura, Kishi et al., Reproduction, 2014 [Research Highlights]) 。
4. 哺乳類の進化的に保存された精原幹細胞ニッチの分子基盤
新学術領域研究 (公募研究), H26-29年度 動物における配偶子産生システムの制御1) 哺乳類の精細管基部に位置する新規の精原幹細胞(SSC)ニッチの発見
哺乳動物では、精巣の曲精細管内で恒常的に膨大な数の精子が生産され、直精細管-精巣網を経て、精巣上体へと運ばれる。 これは、精原幹細胞(SSC)の自己複製により一定のSSC数を維持しながら、精子発生を進行することによる。 SSCの自己複製には、セルトリ細胞から分泌されるTGFβファミリーのGDNF因子(図1,緑)が必須である。 GDNFは、精細管の基底区画内に分泌され、SSCの細胞表面のGDNF受容体であるGFRα1(図1,赤)を介して作用し、 濃度依存的にSSCの自己複製/分化抑制に機能する (現在、GFRα1陽性細胞=SSCを含む最小の集団)。 SSCの自己複製に関わる多く知見は、 ハエ, 線虫などの無脊椎動物からの研究成果による。 これらの精巣は、哺乳類の曲精細管と類似した管状構造を基本とし、この管構造の基部にSSCニッチと呼ばれる特殊な体細胞構造が存在する。 SSCは、このニッチ領域でのみ維持され、そこから遠位へ離れたSSCは、TGFβ相同因子などのニッチ因子群から解除され、 精子への分化プログラムを開始する。一方、哺乳類の精巣では、SSCは、曲精細管全域の基底区画に幅広く存在し、血管の周囲、 C-KIT+の分化型精原細胞の連結部に接して高頻度に見出されている(図1B 右)。しかし、哺乳動物のSSCニッチの本質は、未だ不明のままであった。
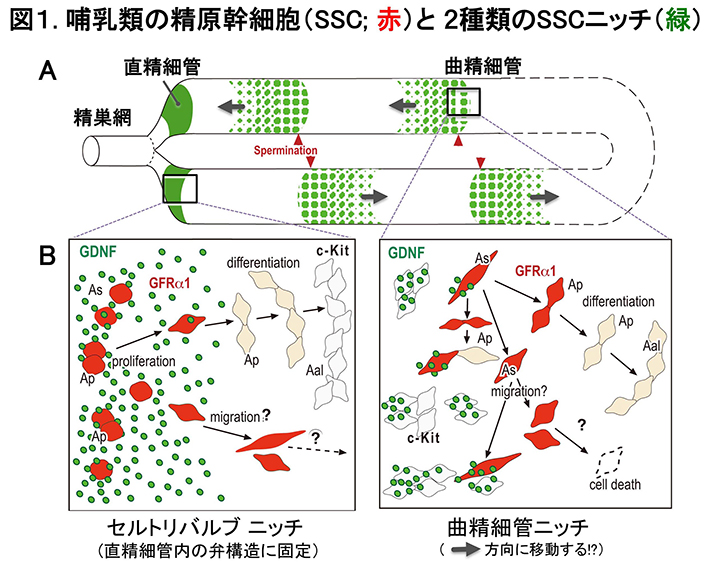
私たちは、全ての曲精細管の基部に存在する直精細管領域の弁様構造(セルトリバルブ; SV)内にSSCニッチ(SVニッチ)が存在すること発見した (図1B左)。この哺乳類のSVニッチは、無脊椎動物のSSCニッチの構造と極めて類似しており、 1) 精巣の全ての精細管の基部に存在し、2)恒常的にニッチ因子(GDNF)が分泌され、 3) SSCの高い増殖活性により恒常的にSSCが維持(BrdU陽性,TUNEL陰性)されると同時に、分化抑制(c-KIT陰性)も起きていることが判明している。 4) SVニッチを構成するセルトリバルブ(SV)細胞は、性成熟後も恒常的に増殖能を維持しており、曲精細管内のセルトリ細胞に寄与すること (セルトリバルブ細胞=成体セルトリ細胞の前駆細胞)も見出した。本成果により、セルトリバルブ(SV)ニッチが、 無脊椎動物から進化的に保存されたSSCニッチであることが強く示唆され、この発見により哺乳動物の生殖幹細胞を維持するニッチの多様性と その起源に関する新たな研究分野の創出が大いに期待される (Aiyama et al., Stem Cells, 2015)。
2) 精巣間質へのin vivoビーズ移植法による精原幹細胞の動態解析
哺乳類の精巣における恒常的な精子発生は、精子を作り出す素となる精原幹細胞 (SSC) により支えられている。 SSCは、自己複製を行い増殖する一方で、分化型細胞も生み出し、このSSCの増殖と分化のバランスは、GDNF等の様々な分泌因子により制御されている。 SSC(≒ As GFRα1陽性細胞)は、細胞間橋を介して連結した状態で同調分裂・増殖し(2つの細胞が連結したAp型、4つ以上の細胞が連結したAal型)、 分化方向へと進行することが知られている。 今まで、遺伝子改変動物、ウイルスベクターを用いた遺伝子組換え実験により、GDNFを高発現下で暴露し続けた環境下において、 精細管内に異常な未分化精原細胞が蓄積することが明らかとなっていた。 しかし、実際の正常な精細管内のSSCが、生体内で一過性にGDNFシグナルを受け取った場合、 どのような時空間的な挙動を示すのか?どのくらいの速さで増殖し、どのような分化段階にある精原細胞塊を、どのような過程を経て集積するのか?etc の多くは不明のままであった。そこで、私たちは、GDNFを吸着させたマイクロビーズを赤色蛍光色素 DiIで標識した後、マウス精巣の間質内へ埋め込み、 (DiIで標識された)精細管断片を網羅的に回収、マーカー解析を可能にするアッセイ法を新たに構築した。 この新規 のin vivo アッセイ法の有効性を、GDNF吸着ビーズと SSCを含むGFRα1陽性の未分化精原細胞の初期動態に焦点を当て、 経時的に細胞塊の構造解析を行った。
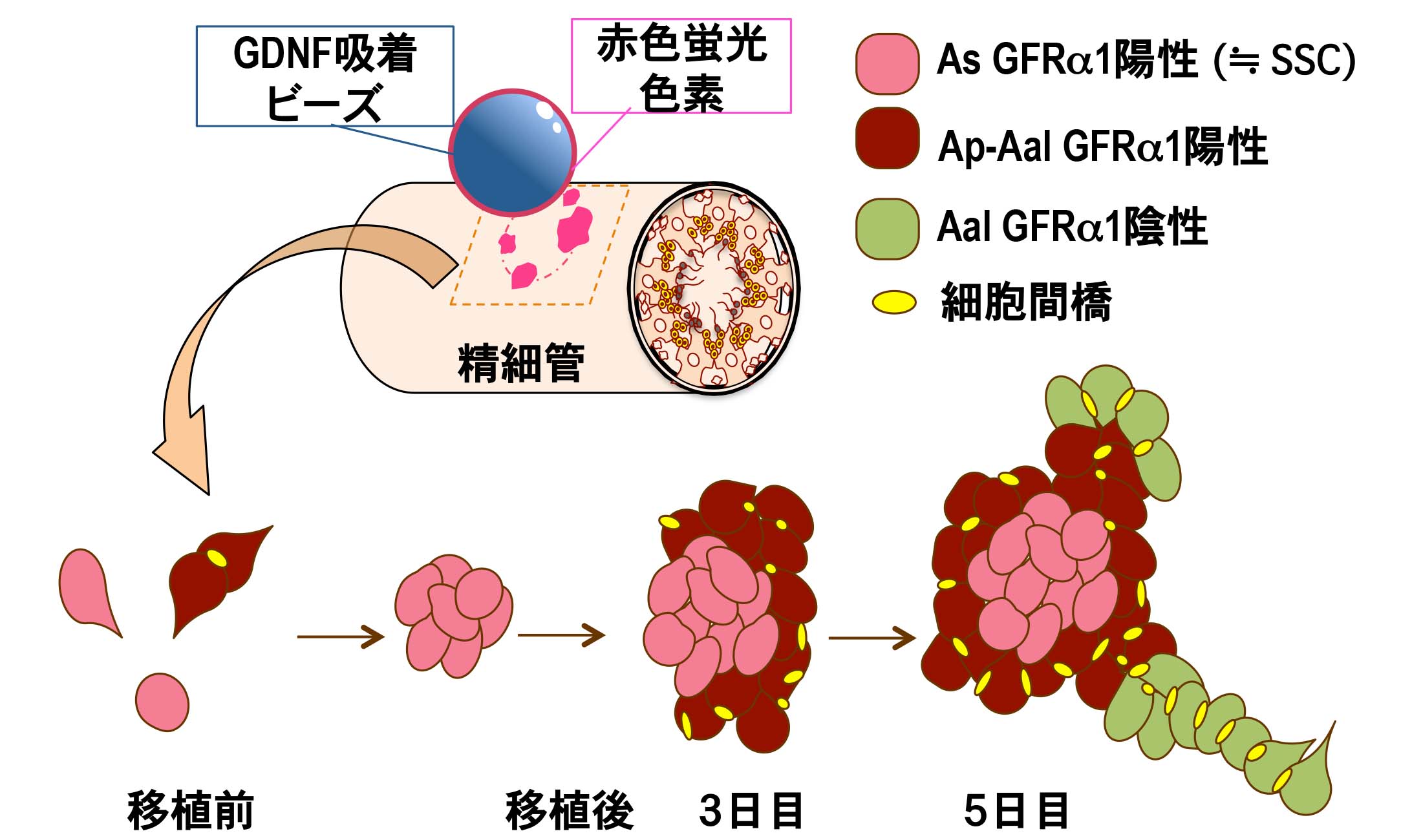
GDNF吸着ビーズに接した精細管壁では、 移植3日までに Cyclin-D1高発現細胞に富むGFRα1陽性の細胞集塊(As GFRα1陽性細胞で構成された中心部と、 その外側にAp-Aal GFRα1陽性細胞群で構成)を形成し、恐らく、このGFRα1陽性集塊の辺縁領域での高い有糸分裂活性により、 移植5日までには、Aal32以上のGFRα1陽性集塊と GFRα1陰性の分化型精原細胞の細胞塊を周囲に誘導することを見出した(図)。 また、このような短時間でのGFRα1陽性細胞の集塊形成は、 白膜直下のビーズ移植とGfrα1ノックインGFPマウス系統を用いた経時的な動態解析でも確認することができた。 以上の結果は、GDNFシグナルの一過性の暴露により、当初、想定されていた以上に短時間(3日以内)で、 SSCを含むAs GFRα1陽性集塊を誘導できることが判明した。また、このようなGFRα1陽性の集塊形成過程は、 W/Wv マウス精巣への精原幹細胞移植における初期のSSCコロニー形成のパターン(Nagai et al., Dev Dyn, 2012) と極めて類似していることから、 精原幹細胞移植によるコロニー形成(SSC expansion)は、GDNFシグナルが中心的な役割を担っていることが示唆された。 さらに、この新規アッセイ法は、GDNF以外の多様な分泌因子においても、生体内での機能を探る上で有用なアッセイ法として期待されるため、 引き続き、GFRα1陽性細胞の動態に変化を与えることができる他の様々な液性因子の影響を解析している (Uchida et al., BBRC, 2016)。
3) 精原細胞における脱ユビキチン化酵素 USP9Xの機能解明
細胞内のタンパク質は、“ユビキチン (Ub)” 化の修飾を受けると、ユビキチン-プロテアソーム系によって分解される。 一方で、脱ユビキチン化酵素は、ハサミのようにユビキチン化修飾を切り取るため、そのタンパク質は分解されず安定化する。 ショウジョウバエの生殖細胞の分化過程で、脱ユビキチン化酵素 Faf は、哺乳類の始原生殖細胞に相当する極細胞で発現しており、 生殖細胞分化に重要な役割をもつ生殖質の構成タンパクであるVasaタンパク質を 脱ユビキチン化することにより、生殖細胞形成を制御することが報告されている(挿入図;左)。 我々は、哺乳類におけるFaf オーソログであるUSP9Xが、始原生殖細胞で高発現することを既に見出していた(Noma et al., Mech. Dev., 2002)が、 その哺乳類の生殖細胞における機能は不明であった。
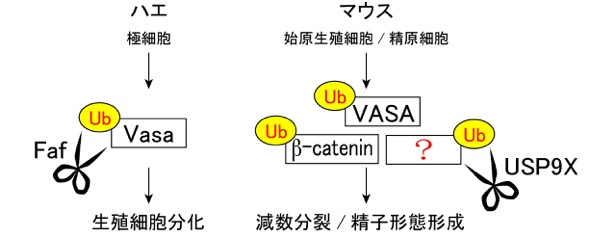
本研究では、雄生殖細胞において、USP9XはGFRα1陽性未分化型精原細胞からKIT陽性分化型精原細胞まで発現していることを確認した。 さらに、Vasa-Cre系統とUsp9x-floxed 系統を用いて、胎子期の生殖細胞からUsp9x遺伝子をコンディショナルノックアウト(cKO)した雄個体を作出し、 その表現型を解析した。 その結果、Usp9x cKO 雄生殖細胞は、GFRα1陽性の精原幹細胞を含む未分化精原細胞を1年以上に渡って安定的に維持でき、 USP9Xは精原幹細胞の維持には必須ではないことが判明した。 USP9Xを発現しているKIT陽性の分化型精原細胞の細胞数も顕著な変化はなかったが、 その後の減数分裂の開始に伴い、アポトーシスする精母細胞の数が顕著に増加した。 さらに、一部生き残った精母細胞も、精子への形態形成の異常により精子形成不全となり、不妊となることが判明した。 本表現型は、Vasa欠損雄マウスの精母細胞での分化異常の表現型とも類似しており、USP9XがVASAを標的タンパクとして安定化させていることも十分考えられる。 また、USP9Xは精巣以外の他の組織においては、beta-cateninなどのタンパク質を標的としている事も知られており、 USP9Xが精原細胞においてこれらの標的タンパクを脱ユビキチン化し安定化することで、 その後の正常な減数分裂の開始、精子形成を制御しているものと推測される(挿入図;右)。 (Kishi et al., Reproduction, 2017)。
5. マウスの卵巣発生での顆粒膜細胞の性的可塑性
基盤A, H29-31年度 哺乳類の生殖腺の性的2型の維持と破綻の分子基盤の解明基盤C, R4-6年度 哺乳類胎子精巣発生の性的堅牢性維持機構の解析
1) 胎子卵巣のテストステロンによる雄性化の分子基盤
ニワトリ、カエル、メダカなどは、一旦、遺伝的に性が決まった後でも性ホルモンの暴露により性転換し、 遺伝的にメス個体にも関わらず妊性のあるオス個体へと成長します。しかし、ヒトを含めた多くの哺乳動物では、 妊娠母体が過剰な男性ホルモンに暴露されても胎子の卵巣発生に大きな影響は無く、性腺の性転換の現象は今まであまり知られていませんでした。 一方、妊娠マウスの母体子宮から雌マウス胎子を取り出し、その胎子卵巣を雄マウス(男性ホルモン優勢環境下)に実験的に移植すると、 移植卵巣から精巣様構造の形成とSOX9陽性のセルトリ様細胞が出現し、部分的な性転換が生じることは分かっていました(Harikae et al., J. Cell Sci., 2013)。 しかし、どのようなホスト側の因子が、どのようにして移植卵巣の雄性化を誘導しているのかは不明のままでした。
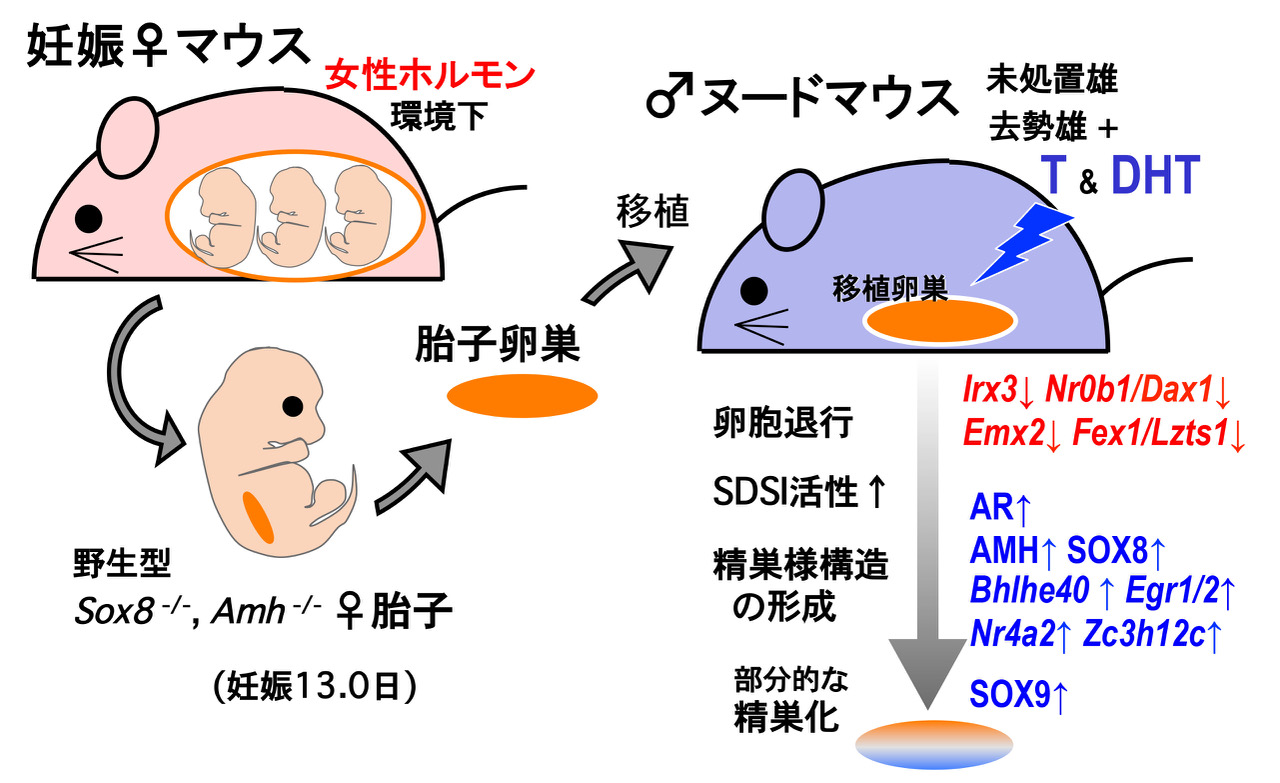
本研究では、ホスト側のヌードマウスを去勢、さらにテストステロン処理下等での移植実験、 Sox8, Amh遺伝子を欠損した卵巣片を移植するという実験を行い、移植卵巣の雄性化の過程を観察しました(図1左)。 その結果、i)上記の下等脊椎動物のメスからオスへの性転換と類似して、ホスト精巣からのテストステロンが、 移植卵巣内のセルトリ様細胞の出現の中心的な役割を担っていることが判明しました(図1右上)。 これは、マウス胎子卵巣がテストステロンにより一部の顆粒膜細胞がセルトリ様細胞へ性転換することを初めて示す例となります。 次に、トランスクリプトーム解析によりこの性転換の過程(移植後0~20日)の遺伝子発現の変化を継時的に解析しました。 ii) 胎子卵巣は、移植後すぐに、いくつかの初期卵巣遺伝子(Irx3, Nr0b1/Dax1, Emx2, and Fez1/Lzts1など) の発現が急速に減少することが判明しました。 これは、SDSI陽性(SOX9転写が起こりやすい状態)の顆粒膜細胞へ誘導される時期と一致します(図1右下)。 また、iii)移植中盤に、精巣化に関わるAr(androgen receptor)、AMH、SOX8の発現が一過性に上昇し、 移植後半までに幾つかの初期精巣転写因子(Egr2, Nr4a2, and Zc3h12c etc)の発現が増加し、SOX9陽性セルトリ様細胞が出現することが判明しました。 さらに、iv)この移植卵巣でのSox8, Amh活性は、SOX9陽性セルトリ様細胞の出現(性転換)には必須ではなく、 移植卵巣での卵胞の退行・精巣様構造の形成を促進することも判明しました。 なお、一部の発現上昇した初期精巣化因子も、成体雌の成熟卵胞の退行、黄体化の過程に発現する因子とoverlapしていることから、 この精巣様構造の形成と卵胞閉鎖・黄体化において共通した転写カスケードが動いていることが考察されます。
本研究成果は、雌胎子に対する卵巣発生の正常な進行における母体環境の重要な役割を再認識すると同時に、 ヒト早期卵巣不全、牛フリーマーチン症などの胎子期のアンドロゲン暴露が病因と想定されている卵巣機能不全の病態解明に大きく繋がるものと考えています (Miura et al., PLoS ONE, 2019)。
2)胎子精巣のセルトリ細胞を除去したら卵巣が誘導されてくるという驚きの事実の発見!
哺乳類の精巣は、性的に未分化な支持細胞において一過性のSRYの発現によりSOX9が誘導され、SOX9が、FGF9、 DHH(ヘッジホッグ因子)、AMH (TGFbファミリー)などの オス化のパラクライン因子の分泌を誘導する。このSOX9下流のパラクライン機能により、セルトリ細胞以外の体細胞、生殖細胞をオス型へと導き精巣を構築する。具体的には、FGF9は、 セルトリ細胞自身のSOX9発現の維持とオス型の生殖細胞の誘導、DHHはライディッヒ細胞(アンドロゲン分泌)の分化を促し、アンドロゲンによりウオルフ管(精巣上体、精管)が発達し、 AMHによりミューラ管(卵管、子宮)が退行し、胎子はオスへと発達する。一方、SRYを持たないメスでは、SOX9の発現が誘導されず、未分化な支持細胞は FOXL2陽性の前顆粒膜細胞(卵胞上皮)へと分化し、 上記のオス化因子の分泌がないため卵巣を構築しメス胎子となる。しかし、卵巣組織を作る前駆細胞が、どこに、どのように存在し、卵巣を構築するのかは不明である。 SRY/SOX9がセルトリ細胞に特有のパラクライン機能を付加し、全ての細胞をオス型へと導くことは分かっていたが、このオス化のパラクライン因子が卵巣化をどのように抑制しているかも不明であった。 私たちは、SOX9+セルトリ細胞のパラクライン機能を調べるため、AMH-TRECKトランスジェニック(Tg)システムを利用し、ジフテリア毒素(DT)によりセルトリ細胞の除去実験を行い、 胎子精巣からオス化のパラクライン因子の無い精巣の発達を継時的に解析した。1)セルトリ細胞の除去後の胎子精巣の転写プロファイルの解析の結果、 胎齢(E)12.5-13.5日の精巣からセルトリ細胞除去により、FOXL2を含む卵巣特異的な遺伝子が異所的に発現上昇することを見出した。2)組織学的にはFOXL2陽性細胞は、 精巣の表層上皮付近と中腎側の精巣間質の領域に異所的に出現することが確認された。3)表層上皮近くのFOXL2陽性細胞は、顆粒膜細胞マーカーであるLgr5とGng13の異所的な発現を伴い、 蛍光標識した精巣上皮の追跡実験、EdUの取り込み実験により精巣上皮から増殖した卵巣索(卵巣皮質に相当し、将来の卵胞上皮)が誘導されることが判明した。 一方、4)中腎側の間質のFOXL2陽性細胞集団は3βHSD陰性(胎子型のライディッヒ細胞では無い)間質系の細胞であり、Tg精巣-EGFP+中腎の再結合実験により、 E11.5以前から性腺実質に定着している内莢膜細胞に相当するものと想定された。5)これらの2つのFOXL2陽性細胞が出現する部位でFgfr1、Fgfr2のFGF受容体と、 ヘパラン硫酸プロテオグリカン(FGFニッチ)が高いレベルで発現しており、さらに、6)精巣から卵巣組織の誘導は、オス化因子の一つであるFGF9の添加により抑制さることも判明した。 これらの研究成果は、胎子精巣の表層上皮および間質領域においてFOXL2誘導可能な卵巣型の前駆細胞が維持されており、胎子セルトリ細胞からのFGF9シグナルが、 これらの卵巣前駆細胞からの卵巣皮質の形成と内莢膜細胞の誘導を抑制していることが判明した。

以上の結果は、SOX9+セルトリ細胞のパラクライン機能は、卵巣索(顆粒膜細胞)と間質の内莢膜細胞の分化を抑制していること、この卵巣形成の抑制には、 セルトリ細胞由来のFGF9が関与していうことが明らかとなった。これは、精巣形成後においてもセルトリ細胞のオス化のパラクライン因子が、精巣内の卵巣前駆細胞の分化抑制に 必須であることを初めて明らかにしたものである (Imaimatsu et al. Development, 2023)。
6. 精細管内のluminal flowを支えるセルトリバルブ(SV)と精子形成の品質保証
新学術領域研究 (公募研究), R1-R2年度 配偶子インテグリティの構築1) 低レチノイン酸(RA)・高FGFシグナルによる精細管基部のセルトリバルブ(弁構造)の形成・維持機構
我々は、曲精細管の基部に存在するセルトリバルブ(SV;セルトリ細胞で構築された弁構造)が、精細管基部に“固定”された精原幹細胞(SSC)ニッチ(“SVニッチ”)であることを発見した(Aiyama et al., 2015)。 また、このSVニッチは、マウスでは生後7日頃から領域化され、曲精細管内を遠位から基部に向かう管腔液の流れ”luminal flow”の逆流防止弁としても重要な機能を担っている(Nagasawa et al., 2018)。 しかし、このSVが、“どのような分子機序で構築されているのか?“、“この弁は本当にセルトリ細胞由来なのか?”などの基本的な情報はなく、SVニッチの分子基盤は今まで不明であった。
本研究では、AMH-TRECKマウスのSV領域をジフテリア毒素により一旦除去し、ドナー由来のセルトリ細胞を移植・置換したSV再構築実験を行った。その結果、SV領域に移植されたセルトリ細胞は非細胞自律的にSVを再構築することが判明した。 すなわち、精巣網と境界を成す精細管内のセルトリ細胞では、精巣網由来のシグナルによりSVが誘導されていることが示唆された。 次に、SV領域の形成機序を明らかにするため、精細胞を欠失したW/Wvマウス精巣のSV領域を単離し、網羅的な遺伝子発現解析を行った。 その結果、SV領域では、 1)低レチノイン酸(RA)・高FGFシグナル状態が維持されていること、 2)生体の精巣のSV領域にRA投与した(RAシグナル活性を上昇させた)結果、RA投与後24時間以内にcKIT+の分化型精原細胞がSV内に異所的に出現し、SV領域内で精母細胞の出現とSVの弁構造の崩壊が生じることが判明した(上流の曲精細管の精子形成障害も誘導)。 さらにRA投与後24時間以内にSVニッチのRARg+/GFRa1+精原細胞が消失し、RARg-/GFRa1+精原細胞(SSCs)も半減することが判明した。以上の結果から、SV領域では低RAシグナル状態によりSVニッチが維持されているだけでなく、RARg+/GFRa1+精原細胞の分化抑制によりSVニッチの維持に機能していることが判明した。
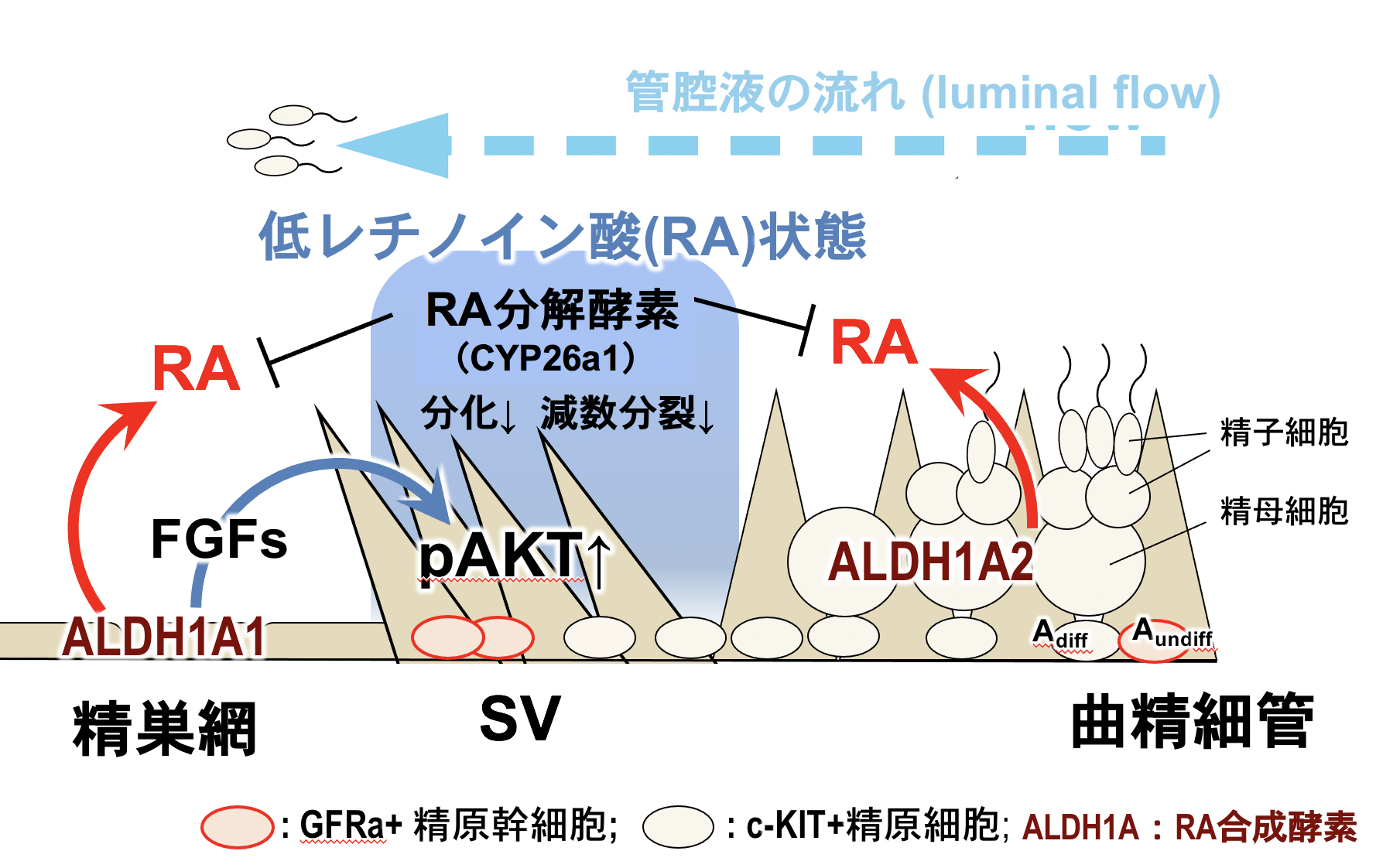
本研究は、セルトリバルブの形成・維持のメカニズムの一端を解明した最初の報告であり、本知見は、哺乳類のSV領域でのSSCニッチの分子基盤の理解だけでなく、luminal flowの逆流防止弁の生理的意義の解明にも貢献するものと考えられる。 (Imura-Kishi, Uchida et al., Sci Rep, 2021)。
2) 精細管内を流れるluminal flowの精巣基部での制御システムの発見!
- SOX17+精巣網のパラクラインによるセルトリバルブ (SV) 制御 -
精巣のセルトリバルブ (SV)の弁構造は、精巣網上皮と隣接する精細管のセルトリ細胞から非細胞自律的に誘導されることが判明している。 しかし、精巣基部のこの精巣網とSVの生理、分子生物学的な研究は始まったばかりであり、“精巣網上皮とは何か?”、“どのような分子機序で弁構造を誘導するのか?”、 “SV弁を構成するセルトリ細胞の実態は?“、“SV弁の曲精細管での役割とは?”など、いまだに不明な点が多い。
一方で、私たちはSOX17がメスの生殖管である子宮上皮に発現しており、胚の着床の直前にSOX17の発現が一過性に上昇すること、このSOX17の一過性の発現上昇が胚の正常な着床に必須であり、 AREGなどの着床部位のパラクライン因子の誘導にも必須であることを既に見出している(Hirate et al., 2016; 2021)。本研究では、オスの生殖管の一部である精巣網上皮でもSOX17が特異的に高発現しており、 この精巣網でのSOX17発現は隣接するSV弁の形成に必須であり、SV弁形成に重要な複数のパラクラインシグナルの誘導を担っていることを以下のように証明した。
精巣網上皮特異的なSox17 cKOマウスにおいて、 1)生後2週齢までは曲精細管で正常に精子発生(精母細胞-初期の円形精子細胞まで)が進み、異常は認められない。しかし、生後4週齢までに、精子形成途中の円形精子細胞が管腔内へ脱落し(巨大な多核の精子細胞の出現)、雄性不妊になることが判明した。 2)Sox17 cKO精巣網上皮と隣接するSV 予定領域では、SV 特異的なpAKT+/ace-TUB+シグナルが消失し、SVでは抑制されている減数分裂(精母細胞の出現)が異所的に起こることが判明した。 3)精巣網管腔液へのtracer標識によりSox17 cKO精巣網と隣接したSV領域ではtracerが上流の曲精細管へと逆流し、これが精子形成異常、不妊の原因であることが判明した。一方、 4)脱落した円形精子細胞は、精巣網から精巣輸出管、精巣上体へと運ばれ、精巣網そのものは生殖管として形態・機能的に正常であることが示唆された。最後に、Sox17 cKOの精巣網-SV領域のシングルセルRNA seq解析により、 5)精巣網上皮では、RSPO1(Wnt4共役因子), TGFb2, FGF9を含む多くのパラクライン因子が高発現しており、cKOではこれらの因子の発現が顕著に低下していること、 6)SV領域のセルトリ細胞は、他のセルトリ細胞と比較して、上記のWNT/TGFb/FGFの受容体、さらにWNT4が高発現しており、精巣網-SV間でRSPO1-WNT4, TGFb, FGFsの局所的なクロストークが存在していることが判明した。
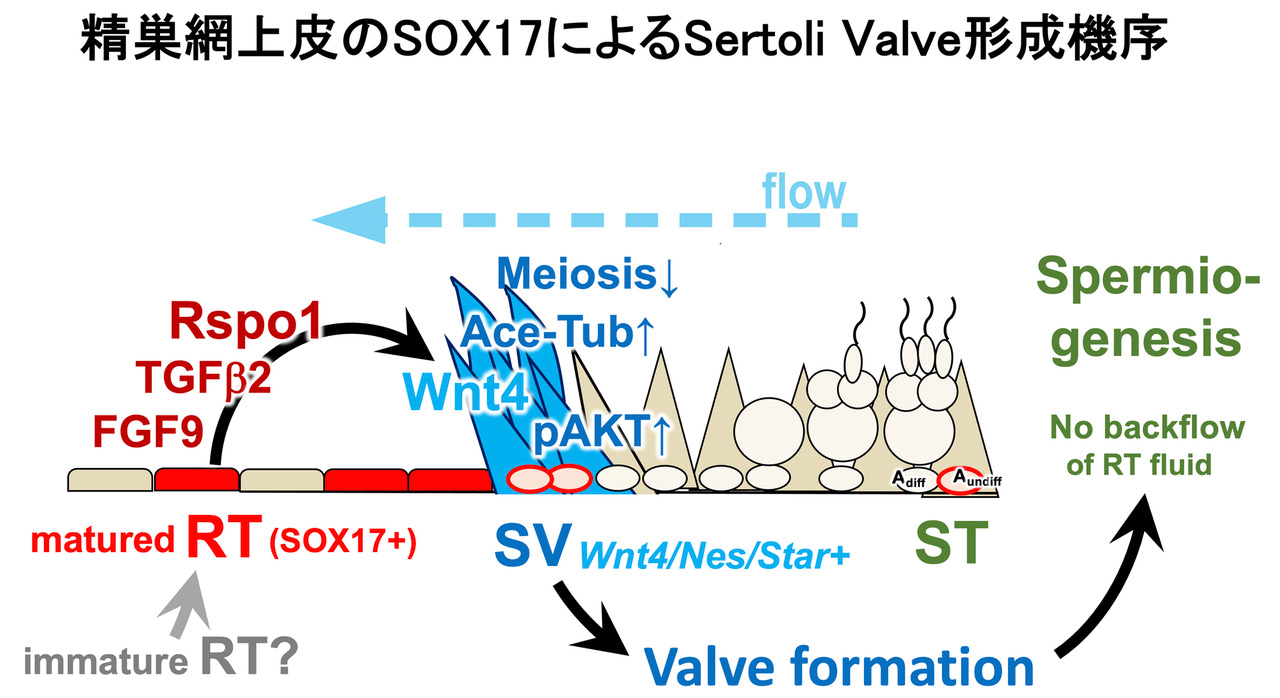
以上の結果から、精巣網上皮のSOX17は、生殖管としての精子を運ぶ機能には直接的に関与せず、pAKT+/ace-TUB+のSV弁の誘導にのみ必須であり、 成熟型の精巣網上皮としてのパラクライン機能に特化した機能を担っているものと想定された。これは、メスの子宮上皮のSOX17の胚着床で特殊化したパラクライン機能と類似しているものと想定される。 また本研究は、精巣基部のSV弁によるluminal flow制御が、精細管側での正常な精子細胞の形態形成に必須であること、 このSV弁の形成にはSOX17+精巣網のパラクラインが必須であることを証明するものである (Uchida et al., Nature Communications, 2022)。