研究紹介
マウス発生過程におけるSRY関連遺伝子SOX17の機能解析
◯主な研究成果(クリックすると各項目のトップに移動します)
- マウスSOX17遺伝子の発見
- マウスSOX17遺伝子欠損マウスの内胚葉形成の異常
- 血管形成におけるSOX17の機能
- 腸管内胚葉の形態形成と始原生殖細胞の移動と分化能
- 前腸組織由来の器官発生におけるSOX17の役割
- 先天性胆道閉鎖と急性肝炎の発症メカニズムの解明
- 透明化法による成体マウスの肝胆道系のマクロ解析手法の確立
- 胆道閉鎖症における胆嚢上皮でのSOX17下流シグナルの解明
- 胆嚢マスター転写因子SOX17による胆嚢の「消失進化」と「胆汁うっ滞」
- SOX17の哺乳動物間の機能多様化の謎を紐解く
1. マウスSOX17遺伝子の発見
一般C, H6年度 マウス生殖細胞に発現するSry 関連遺伝子の単離とその解析一般C, H7年度 マウス生殖細胞の分化に伴うSox17遺伝子の機能調節機構の解析
基盤C, H8年度 マウス生殖細胞におけるSry関連HMG box蛋白の機能と相互作用
Sox17を、マウス精巣cDNAからdegenerate primerを用いたPCRにより新規のSox遺伝子として単離し、 DNA結合領域を含むエクソンのスプライシングの違いにより活性型と不活性型の2種類のmRNAが存在することを明らかにした。 (Kanai Y et al., J Cell Biol, 1996)
2. マウスSOX17遺伝子欠損マウスの内胚葉形成の異常
基盤C, H11-12年度 ノックアウトマウスを用いたSox17遺伝子の個体レベルの機能解析基盤C, H13-14年度 内胚葉形成過程におけるSox17遺伝子の自律的分化能の解析
マウス初期発生を含む発現解析の結果、Sox17は、生殖細胞以外に、初期の胚性内胚葉、 肝臓や膵臓などの内胚葉由来細胞と血管内皮、生後では神経膠細胞において発現していることを示した。 さらに、我々は、Sox17欠損マウスを作出し、胚性内胚葉細胞の初期分化の異常により腸原基形成が阻害され、 胎齢10日までに胎生致死となることを明らかにした。 (Kanai-Azuma M, Kanai Y, et al., Development, 2002 ; Sohn et al., J Neurosci, 2006)
Sox17の自律的機能を検討するため、Sox17欠損ES細胞株を単離し、ROSAマウス(全細胞がLacZ陽性)とのキメラ解析により、 胎齢7.5-9.5日のキメラ胚でのSox17欠損ES細胞の各組織への分化能について検討した。その結果、 Sox17欠損ES細胞は高頻度に血管内皮細胞を含めた中胚葉、外胚葉由来組織に分化していたのに対し、 内胚葉由来である腸原基では、ほぼ宿主由来の細胞で構成されていることを見い出した。 本結果は、Sox17が、自律的に胚性内胚葉への分化に必須の機能を担っていることを初めて証明するものである。 (Tam P, Kanai-Azuma M, Kanai Y. Curr Opin Genet Dev, 2003)
3. 血管形成におけるSOX17の機能
基盤C, H15-16年度 Sox17/Sox18の二重遺伝子改変マウスを用いた血管形成の分子機構の解析基盤B, H17-18年度 遺伝子改変マウスを用いたSox17/18の血管形成の分子機構の解析
Sox17遺伝子は、胎子血管の内皮細胞などに強く発現しているが、その欠損マウスでの血管形成は正常に分化する。 この原因として、血管内皮細胞に発現を示すSox18遺伝子が、Sox17欠損個体の血管形成において相補的に機能している可能性が考えられた。 そこで、Sox17とSox18の相補性を検討するため、Sox18欠損マウス(CD1系統;正常な発育、繁殖、異常無し)をSox17改変マウスに掛け合わせ、 Sox17+/−/Sox18-/−マウスの表現型を解析した。その結果、Sox17+/−/Sox18-/−マウスの半数は、 一部の臓器の血管構築の形成不全により生後3週齢までに致死となること、また生き残った成熟個体においても、 卵巣の機能不全により不妊となることが判明した。これらの結果は、Sox17は、Sox18と相補的に血管形成にも重要な 機能を担っていることを示唆している。 (Matsui et al. J Cell Sci, 2006; Sakamoto, Hara, BBRC ,2007)
4. 腸管内胚葉の形態形成と始原生殖細胞の移動と分化能
腸管内胚葉形成とPGCsの胚外(胎盤など)から胚内(後腸から腸間膜を経て生殖腺) への最初の移動との関連性を明らかにすることを目的とし、 Sox17 欠損マウス胚におけるPGCsの移動パターンを解析した。 その結果、興味深いことに、胚内へ移動できない異所的(胚体外に留まった)PGCsが多数観察された (図1)。 キメラによるレスキュー解析により、腸管内胚葉のみがwildtype由来の正常細胞に置き換わったSox17欠損胚 では、Sox17 が欠損したPGCsでも、 正常に胚内(後腸内)へ移動することが確認された。以上の結果から、我々哺乳動物の 生殖細胞は、腸管内胚葉組織付近に侵入直後、腸管内胚葉の形態形成の物理的な力(集団移動) を利用してPGCsが将来の生殖巣の 近くまで移動することが遺伝学的に証明された (図2:ベルトコンベヤー仮説)。このシステムは、荷物 [PGCs]が ベルトコンベヤー[腸管内胚葉]に載って目的地[生殖腺] まで運ばれるのに似ており、 連続して永遠と続く哺乳類の生命の連続性を 保証するシステムとしては、あまりにも他力本願なシステムではないかと感じる。また、このようなシステムは、異所的な生殖細胞の 増加を生み、 一部、生後まで生き残った未分化なPGCsが胎児の腫瘍の原因となる可能性を生み出すものと推測される。 (Hara et al., Dev Biol, 2009)
5. 前腸組織由来の器官発生におけるSOX17の役割
基盤B, H19-20年度 肝臓発生における内胚葉形成因子SOX17の役割基盤A, H21-23年度 内胚葉形成因子SOX17の肝臓,胆管,膵臓発生における役割
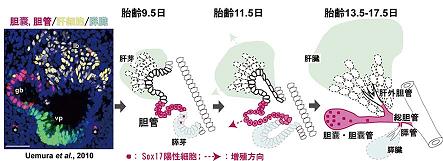
肝臓、膵臓、胆嚢・胆管の起源は、器官形成の初期において、原始腸管(シート状の内胚葉層が管状化した腸管)の前腸の 腹側後方の一部分が伸び出すことにより発生します。 肝臓と膵臓の原基は、心臓原基と隣接する横中隔からのシグナル因子により 前腸の正中腹側領域から生じることが示され (図1Aの灰色部分)、 その分化の制御機序についても精力的な解析がなされ多くの知見が 蓄積してきています。しかし、残りの胆嚢・胆管の形成機序については、 前腸からの特異化およびその前駆細胞の分化の制御機序 など、ほとんど理解されていません。 私たちは、内胚葉への初期分化の過程でSox17が一過性に発現した後、前腸組織の胆嚢・胆管原基 においてSox17が再び活性化し、 後の分化ステージまで胆嚢領域でSox17を発現、維持していることが 分かっていました (Matsui et al., 2006)。 この胆嚢特異的なSox17の再活性化は、内胚葉由来の胆嚢の形成・発達においても 重要な機能を担っていることを示唆しています。 そこで、我々は、マウスの胆嚢・胆管原基の初期決定における詳細な解析を 行い、以下のようにSox17が胆嚢・胆管の前駆細胞の分化に自律的に必須であることを突き止めました。
a) 前腸領域での最初のSox17の発現は、左右の前腸門 (anterior intestinal portal;管状化している管の開口部) の外側後方 (管状化する前のシート状の前腸内胚葉層)の部位 (図1A左の赤領域)で起こる。 その後、腸管形成に伴い(管状化の形態形成運動により)、Sox17陽性の前駆細胞の集団は、腹側・正中方向へと伸展・移動し、管腔の構 築後には腹側正中線に沿って肝臓と膵臓間の胆嚢・胆管予定領域にすっぽり収まる (図1A右の赤領域)。 b) 胆嚢・胆管予定領域でのSox17の発現開始時期(8.25dpc)は、肝臓や膵臓の前駆細胞の 分化誘導(マーカー遺伝子の発現)とほぼ同時である(胆嚢・胆管、肝臓、膵臓の3つの予定領域は、ほぼ同時に決定)。 c) Sox17欠損マウスでは、初期胚の前腸内胚葉の細胞数の不足により、胆嚢・胆管の 予定領域(Sox17の再活性化領域)を含む前腸の左右の外側内胚葉領域(図1B,Cの斜線)が欠失する。このため に、Sox17欠損胚は、胆嚢・胆管(と膵臓)の形成不全を呈する。 d) Sox17欠損ES細胞とのキメラ解析により、Sox17欠損内胚葉細胞は、前腸の左右の 外側内胚葉領域 (図1B,Cの斜線)への寄与率は著しく低い。さらに、まれに寄与した少数のSox17欠損 細胞において、胆嚢・胆管マーカーの発現が特異的に消失しており、胆嚢・胆管前駆細胞への自律的な分化能が 欠失している。
本成果により、胆嚢・胆管前駆細胞の決定は、心臓原基・横中隔の正中部位から外側にかなり外れた 前腸後端部(左右一対)で、 肝臓、膵臓の決定と同時に(おそらく独立的に)起こり、腸管の管状化の形態形成の力に より、本来の位置である肝臓と膵臓の間にソーティングされることが明らかとなりました。 本研究は、肝臓、膵臓を十二指腸へ と繋ぐ胆管システムの形成機序の大きな理解につながると考えています。 (Uemura et al., BBRC, 2009)
また、我々は、Sox17変異マウスの維持する過程で、その129系統の遺伝的背景を C57BL/6系統に移した結果、5世代以上のSox17ヘテロ個体の90%以上が,ハプロ不全により胎齢 16日の胎子の肝臓に炎症を伴う肝細胞の変性が生じることを見い出しています。 現在,こちらの方の詳細な原因 についても解析を行っています。
6. 先天性胆道閉鎖と急性肝炎の発症メカニズムの解明
基盤S, H23-27年度 胆嚢・胆管の形態形成・再生能と先天性疾患の分子機構の解明ヒト 先天性胆道閉鎖症(congenital biliary atresia)は、新生児1万人のうち1人に発症(肝硬変から死に至る重要疾患)し、小児の肝移植の原因疾患の約70%を占めています。その原因は、胎生期において胆管上皮の形成、維持がうまくいかず、胆管上皮構造の破綻によるものと推定されていますが、残念ながら、その原因遺伝子、発症メカニズムの大部分は不明のままであります。私たちは,胎生期の胆管上皮前駆細胞でのSOX17の発現量の半量程度の低下により、細胞自律的に胆管上皮の管腔内への脱落(上皮破綻)を誘導し、妊娠後期での胆道閉塞と急性肝炎を引き起こすことを見出しました。
成果内容: (1)私達は、SOX17が器官形成期の前腸の胆管前駆細胞(胆嚢・胆管・総胆管と肝・膵管の一部も含まれる)の予定領域に おいて再び活性化することは報告していました(Uemura et al., 2010)。SOX17発現は,胆嚢/胆管原基の遠位端(胆嚢領域)に存在する高い 細胞増殖活性を維持した胆管前駆細胞において、妊娠後期までその発現が維持されることが判明しました(赤丸,上図)。発生過程を とおして、SOX17陽性の胆管前駆細胞は、高い増殖活性を維持し、Sox17欠損胚では胆管前駆細胞が消失(胆管の消失)することから、SOX17陽性 の胆管前駆細胞は、肝外胆管の形態形成の主役を演じ、その大部分の構築に寄与することが示唆され ます(赤領域,上図)。 (2) Sox17 +/- (ヘテロ)マウス (C57BL/6[B6]系統)では、胆管前駆細胞の増殖能が低下し、胎齢13.5日 頃から 異所性の肝外胆管の形成と胆嚢の低形成が誘導されることが判明しました。さらに、Sox17 +/-胆嚢・胆管上皮細胞は、管腔内へと 容易に剥離し、胆管の上皮構造が破綻すること、さらに、脱落した上皮細胞塊が下流の肝外胆管、総胆管部でトラップされ、胆道閉塞 を誘発することが明らかとなりました(下図)。(3)詳細な器官培養系での解析の結果、遠近軸に沿っての胆管原基の伸長率の低下、上皮の部分的な 基底膜の断片化と細胞自律的に腔内へ上皮細胞が脱落することが判明しました。基底膜ゲルを添加し、基底膜形成を正常化 しても、Sox17 +/-胆管上皮細胞の増殖能の低下,管腔構造の伸長異常は回復しませんでした。本結果は、SOX17の発現量の低下に より、細胞自律的な胆管上皮の脱落が誘導され、胆管上皮構造の損傷と脱落細胞による胆道閉塞が容易に誘導されることが判明 しました。 (4)マウス個体発生では、胎齢16.5日頃から胎子肝臓からの胆汁の十二指腸への排出が開始します。これらのSox17 +/- (B6) 胎子 では、その約70%の個体が,これらの胆道形成の異常により、胆汁の排出開始後すぐに肝内胆汁酸値の上昇と肝細胞の小胞体ストレスの 増加に伴い、出生までに急性の劇症肝炎を発症することが判明しました(下図)。
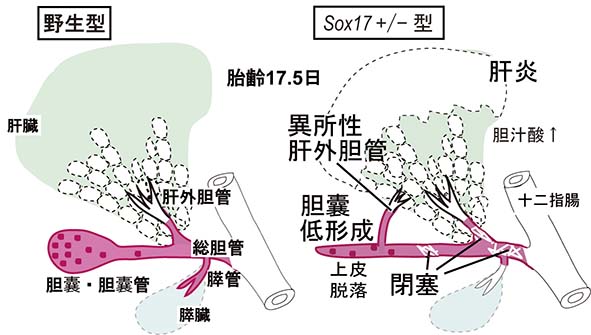
本成果は、新生子期に、胆管前駆細胞でのSOX17発現の半量程度の低下により肝外胆管の 上皮破綻/胆管閉鎖と急性肝炎を引き起こすことを示した世界初の研究成果であります。これは、胆管上皮での SOX17とその関連因子群が、ヒト先天性胆道閉鎖症の原因遺伝子となりえることが強く示唆します。今後、胆管前 駆細胞でのSOX17の上流/下流因子の探索が、ヒト先天性胆道閉鎖症の発症機序の解明に大きく繋がり、先天性胆道閉鎖症 の出生前診断法の開発に大きく役立つものと考えられます。(Uemura, Ozawa et al., Development, 2013)
7. 透明化法による成体マウスの肝胆道系のマクロ解析手法の確立
基盤S, H23-27年度 胆嚢・胆管の形態形成・再生能と先天性疾患の分子機構の解明マウスは肝胆道閉鎖症をはじめ、様々なヒトの疾患モデルとして非常に重要である。 ところがマウスを用いた実験系での肝胆道系の奇形・疾患・炎症が、ヒトの様々な胆道系の疾患とどの程度まで対応付けられるのかに関しては不明な点が多い。 これは肝胆道系のマクロレベルでの構造が、どこまでヒトと類似しているのかが不詳であることにも起因する。
胆嚢を含む肝胆道系は哺乳類、中でも齧歯類において極めて変化に富むことが知られるが、 実はマウスの肝胆道系の詳細な記載はこれまでほとんどなかった。 その理由には、病理解剖するにはマウスの肝胆道系は小型でかつ不透明であるという点が挙げられる。 そこで、我々は,近年開発された透明化法のひとつであるCUBIC法(Susaki et al., 2014. Cell 157, 726-739)を用いて、 成体マウス肝・膵・胆道を丸ごと透明化し、実体顕微鏡下での詳細な解剖学的記載をおこなってヒトとの共通・相違点を明示した。
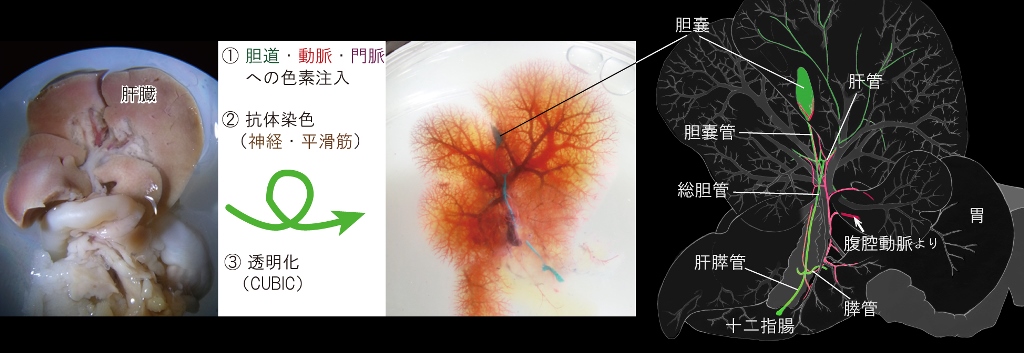
結果、マウスの肝胆道系の胆道と伴う血管・神経・平滑筋の立体構造は、 i) 一部の動脈の走行パターン、 ii) 肝膵管括約筋の形態、 iii) 膵管の分岐位置の3点を除けば、ヒト同様であることが確認された。 本成果は、マウスの肝胆道系がヒトの疾患モデルとして非常に有用であることの裏付けるものである。 すなわち、Sox17ハプロ不全による胆道閉鎖モデルマウスはやはりヒトのモデルとして重要な意義をもつだろう。 (Higashiyama et al. Anat Rec, 2015)
8. 胆道閉鎖症における胆嚢上皮でのSOX17下流シグナルの解明
基盤S, H23-27年度 胆嚢・胆管の形態形成・再生能と先天性疾患の分子機構の解明1) Sox17ハプロ不全による胆道閉鎖症は、器官形成期からの胆嚢炎とShhシグナルを介した平滑筋収縮障害による胆汁うっ滞により誘導される!
胆道閉鎖症(BA)は、胎児期から乳児期早期にかけて発症する難治性の胆汁うっ滞疾患である。 またヒトのみならず、羊、牛、犬、マウスを含めた、胆嚢を有する哺乳動物で発症する獣医学領域の新生子疾患でもある。 これまでの研究で、Sox17+/- (ヘテロ) マウスが、ヒトBAと類似した症状を呈し、出生期までに肝障害を発症することは判明していた。 しかし、「SOX17のたった半量低下で何が起きているのか?」 「SOX17下流のシグナルは何?」 「どうして脱落片が胆道の途中で詰まってしまうの?」 また「本当に胆嚢上皮でのSOX17の低下が肝障害の直接的な病因になっているのか?」 など、BA発症の分子メカニズムは全くの不明であった。 本研究では、胆嚢上皮でのSOX17半量低下による胎子胆嚢の遺伝子発現の変化、胆嚢の形態形成異常と器官形成期での炎症、 胆道閉鎖を誘導する胆汁うっ滞の発生機序まで、その全貌を以下のように解明した。
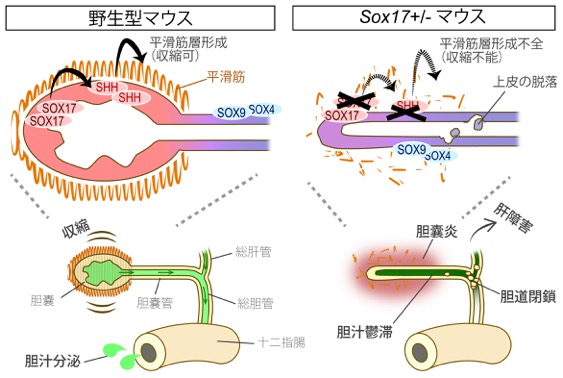
成果内容:胆嚢特異的なconditional (cd) Sox17欠損マウスで、 BA発症と肝障害が誘導されることを遺伝学的に証明した(肝臓特異的なcd Sox17欠損マウスは肝障害もなく正常)。 また、トランスクリプトーム解析と器官培養系の解析により、Sox17+/-マウスの胆嚢上皮細胞が、 胆嚢管・肝管・肝内胆管に類似したSOX9+/SOX4+細胞へ脱分化すること、 細胞自律的に生じる上皮細胞の脱落により胆嚢炎(胎子胆嚢周囲への骨髄球の浸潤)を発症することが明らかとなった。 この結果は、Sox17+/-胆嚢上皮の肝管様細胞への脱分化とその上皮脱落による胆嚢炎の発症が、 SOX9+/SOX4+の脱落死細胞への免疫応答に繋がり、その後の肝内胆管まで広がる慢性炎症の一因となる可能性を強く示唆する。 さらに、Sox17+/-胆嚢上皮においてShhシグナルが顕著に低下し、胆嚢周囲の平滑筋層の形成異常と収縮能の低下を招くこと、 また収縮能の低下と胆嚢炎の重篤度は、肝臓障害の重篤度と正の相関を示すことも判明した。 以上の結果は、SOX17下流のShhシグナルが正常な胆嚢平滑筋層の形成に必須であり、 かつ胎子期の胆嚢収縮能の低下が胆汁うっ滞の要因となって、BA発症に深く関与することを示している。
ヒトBAは1万人に1人(年間100人)程度の希少疾患であるため、その原因と病態は現在も全く不明のままである。 本研究は世界に先駆けて、胎子胆嚢・胆道系でのBA発症の病因から初期病態の全貌を解明したものである。 胎児期の胆嚢炎と胆嚢平滑筋の自律的収縮の側面から、ヒトBAの新たな診断技術やBA発症の予防法、治療法の開発まで幅広く貢献するものと考えられる。 (Higashiyama, Ozawa, Sumitomo, Uemura et al., Development, 2017)
2) ラット腹側前腸の胆管原基予定領域でのSOX17発現能と胆嚢の消失
ヘビの肢や洞窟魚の眼のように、動物の進化の歴史では「失う」ということが頻繁に起こる。 実は胆嚢は哺乳類の中で何度も失われているのだが、胆嚢がある状態とない状態がどのような発生過程の差で生まれるのかは謎だった。 齧歯類のなかでマウスとラットは系統的に近く、また食べ物など生活史も似通っているにも関わらず、マウスは胆嚢を持ちラットは全く持っていない。 この二者での胆嚢形成に必須であるSOX17の発現パターンを比較することで、ラットで胆嚢が消失した要因の糸口を探った。
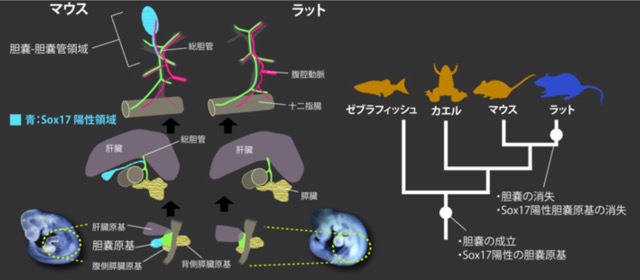
まず、胆道系と血管に色素を注入してCUBIC法によりそれぞれ成体の肝胆道系を可視化した。 その結果、マウスとラットでの形態的な差はあくまで胆嚢-胆嚢管に限局し、 それ以外は血管を含めて全く同じパターンを持つことが分かった。 発生過程を形態的に比較すると、マウスの胆嚢は肝外胆管のうち総肝管の分岐点よりも遠位の部分が腹側に伸びて形成されるのに対し、 ラットでは同じ部位がまったく伸びないことが分かった。 更に胆嚢や肝臓に発現する分子のパターンを調べると、マウスでは肝臓、胆嚢、膵臓原基にそれぞれHNF4a、SOX17、PDX1が陽性になるのに対し、 ラット同部位はHNF4aとPDX1で占められ、SOX17陽性の細胞がまったく存在しないことが判明した。 SOX17はゼブラフィッシュやアフリカツメガエルでも胆嚢特異的に発現する分子であり、系統的に見ても、 ラットでの胆嚢の消失は胆嚢原基特異的なSOX17発現の消失と同時期と推測される。 胆嚢を持たない他の哺乳類のデータは少ないが、いずれもほとんどの肝胆道系の形態を維持したまま胆嚢-胆嚢管領域を失っていることを鑑みると、 ラットと同様の過程で、胆道系でのSOX17発現能の消失により胆嚢を失っている可能性がある。 胆嚢は鳥類でも何度も失われているが、哺乳類と鳥以外ではほとんど失われていない。 どんな要因が失われやすい系統/失われにくい系統を区別するのかはまだ明らかではないため、今後、ラットでのSOX17の発現の消失メカニズム、様々な胆嚢の無い動物を使ったSOX17発現制御の研究が必要になるだろう。 (Higashiyama, et al., 2017. Journal of Anatomy)
9. 胆嚢マスター転写因子SOX17による胆嚢の「消失進化」と「胆汁うっ滞」
基盤A, R2-4年度 胆嚢のマスター遺伝子SOX17の発現制御と胆汁うっ滞性疾患1) ヒト胆道閉鎖症(BA)の遺残胆嚢から胎児期のBA病態を推理する!?
—ヒトBA遺残胆嚢からSOX17発現低下の傷痕—
これまでのマウスBA(Sox17 +/-)モデルの研究により、胎子胆嚢でのSox17発現量の低下が引き金となり胆嚢炎を発症し、ヒトBAと類似した胆道閉鎖症が誘導されることを示してきた。しかし、実際にヒトBAの赤ちゃんで「遺残胆嚢で何が起きているのか?患者さんの胎子期に胆嚢や肝外胆管で何が起きたのか?」という問いに関してはほぼ不明のままであった。本研究は、Sox17+/-マウスの新生子胆嚢とヒトBA (isolated型のtype III-a,-b)の遺残胆嚢を用いてSOX17/SOX9の発現レベルと病理学的な特徴を比較解析した。その結果、マウスSox17+/-BA胆嚢とヒトBA胆嚢での共通の傷痕としてPBG(胆管腺)の異所的形成を見出した。
最初に、マウスSox17+/-BAの胆嚢上皮ではSOX9発現上昇により胆嚢上皮が胆嚢管様に脱分化する(Higashiyama et al., 2017)ことから、胆嚢管の特徴であるPBG(胆管腺)に着目した。PBG(胆管腺)は、成体では胆管上皮の幹細胞のニッチとして機能し、胆嚢以外の肝外胆管(胆嚢管、肝管、総胆管など)に広く分布することが知られている。マウスPBGの形成は、生後すぐに胆嚢管のみで小さな発芽の開始として認められ、生後7日齢にはSOX9+上皮細胞を含む腺構造が形成される。野生型のマウス胆嚢ではPBGのような腺構造は認められないが、Sox17+/-BA胆嚢では多数のPBGsが異所的に形成されることが判明した。次に、ヒトBAの13症例の遺残胆嚢(葛西手術時に最も胆嚢壁の構造が維持されていたサンプル)を解析した結果、13症例のうち5つの症例(約38%)で顕著にSOX17の発現が減少していることが判明した。興味深いことに、11/13症例の胆嚢上皮で、有意に胆管腺の増生(病理学的には偽幽門腺化生)が認められ、胆道拡張症などの非BA群、対照群では、このような異所的な胆管腺の形成は認められなかった。以上の結果は、ヒトBA胆嚢でも、Sox17+/-BA胆嚢で見られる異所的なPBGの形成が起こっていること、つまりヒトBA胆嚢でも胎児期の胆嚢上皮でSOX17発現量が低下(胆嚢管化)していた可能性を示唆する結果となった。
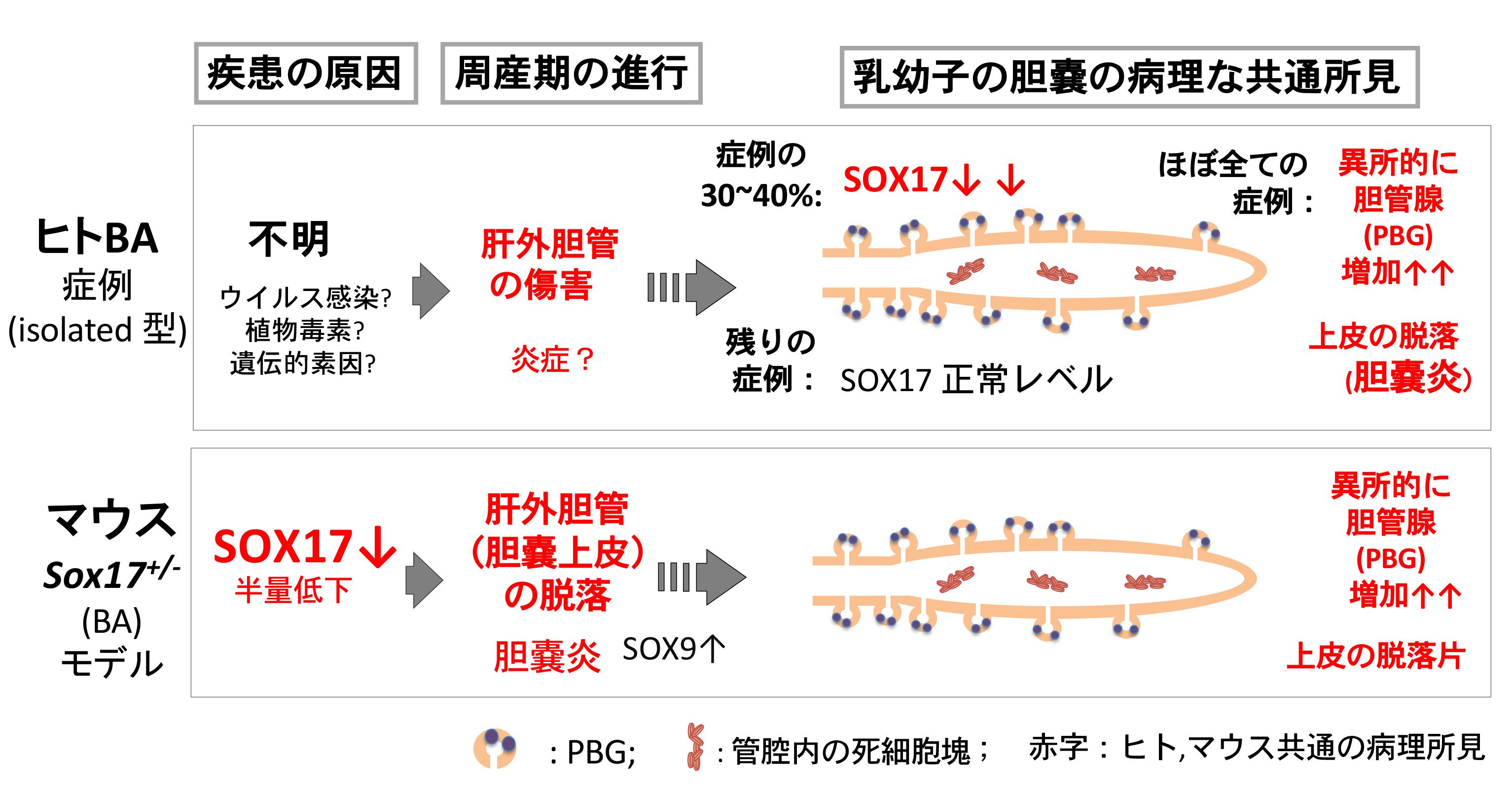
本研究では、ヒト胆道閉鎖症(isolated型) 症例の約4割で胆嚢上皮でのSOX17発現の低下が認められ、8割以上で胎児期のSOX17の発現低下の後遺症とも考えられるPBGの異所的な増加が観察された。本研究成果は、SOX17発現の低下が、ヒトBAでの肝外胆管の初期病態に深く関与している可能性を示唆する新知見となった。今後、BAによる肝外胆管のdamageの指標として胆嚢上皮の異所的なPBGの形成に着目することで、新しいBAの早期診断法の開発に繋がるものと考えている(Uemura, Higashi et al., Dis Model Mech, 2020)。
筆頭著者のインタビュー
2) 胆道閉鎖症(BA)の死から逃れたSox17+/- 生存マウスからBAの治癒法を学べるか!?
ヒトの胆道閉鎖症(BA)の多くは、無治療であれば非代償性肝硬変となり生後1年以内に死亡する。Sox17の発現が半量程度に低下した Sox17+/- BAモデルも、ヒトBAと類似した胆道閉鎖症を発症し、その多くの新生子が生後すぐに致死となる。しかし、Sox17+/-マウスの多くが新生子致死となる一方で、哺乳期を越えて生き残ったSox17+/-マウス(Sox17+/-生存マウス)は同腹の野生型マウスと同様に成体まで成長し、通常の寿命である1年以上を超えて長生きする。
本研究では、このBAモデルマウスの一部の生存個体が、「どのようにして胎子期のBAの致死的傷害から逃れて、どのように回復したのか?」を理解することを目的とし、Sox17+/-生存マウスの肝・胆道系の表現系・破格を解剖学・組織学的に解析した。
Sox17+/-生存マウス(3,7週齢)と同腹の野生型マウスを詳細に比較解析した結果、胆嚢の低形成、肝辺縁の石灰化・拡張した血管の異常走行、異所性肝管の形成が認められ、これらは胎子期のBAによる後遺症であることが想定された。全ての生存個体(7週齢)で、胆嚢からのlatexがスムーズに注入されることから、この時期では胆道閉鎖の原因は解消されており、組織学的にも胆嚢上皮は正常で肝炎も自然治癒していることが判明した。以上の結果から、胆嚢管の下流領域の肝外胆管での胆道閉鎖の原因の解消が生死を分けており、おそらく、胆嚢上皮由来の脱落した死細胞塊により閉塞した肝管、総胆管が、偶発的な要因により開通(死細胞塊の十二指腸へ排出)したため生存できたと想定された。
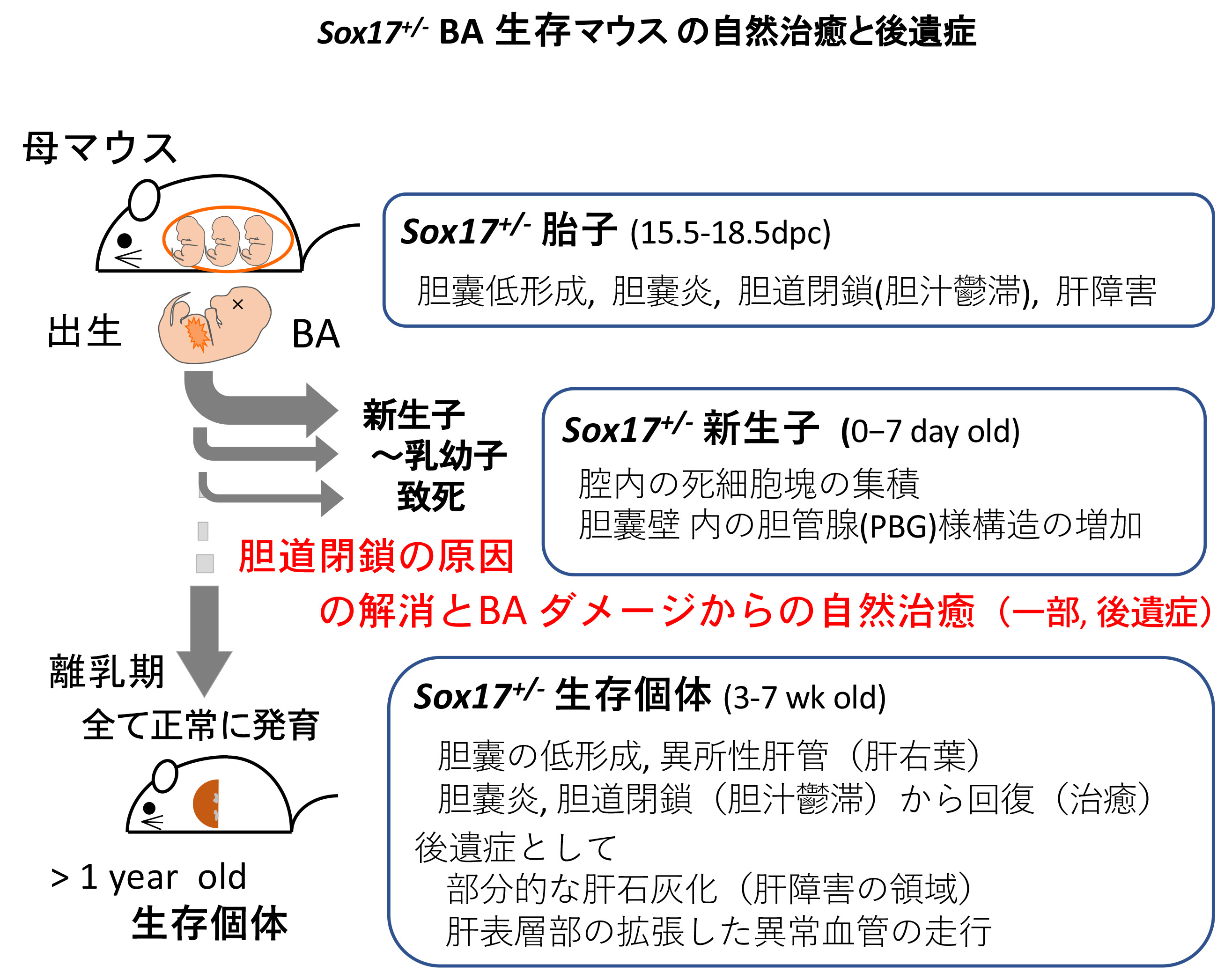
今回のSox17+/-マウスの肝臓の自然治癒過程は、ヒトBAの葛西手術後の肝障害からの治癒過程と深く関連しているものと考えられ、葛西手術後のBA治癒のマウスモデルとしてSox17+/-生存マウスの解析は非常に有効であると想定される。今後、Sox17+/-生存マウスの胆道閉鎖の治癒過程を学ぶことにより、新規のBA治療法、創薬開発に利用できるヒントが得られるものと考えている(Pattarapanawan et al., Anat Rec, 2020) 。
3) ウズラとハトの肝外胆管の比較からみえてくる、鳥類の胆嚢と胆道系の進化
胆嚢は脊椎動物の共通祖先で獲得された器官である。しかし、ほとんどの脊椎動物がこの器官を維持しているにもかかわらず、哺乳類と鳥の一部の系統だけで、タガが外れたように胆嚢は何度も失われている。この胆嚢の消失進化は古くから知られる問題ではあるものの、それに伴って肝管・胆管・膵管系にどんな形態的変化が起こるのかは長らく不明であった。特に鳥類の肝・胆・膵管系は、その肉眼解剖的記載さえもあまりに不十分である。本研究では、本教室において古くから保存されてきたハト(胆嚢なし)とウズラ(胆嚢あり)の標本を用い、透明化試薬であるCUBICで組織を透明化して肝胆膵系の比較をおこなった。
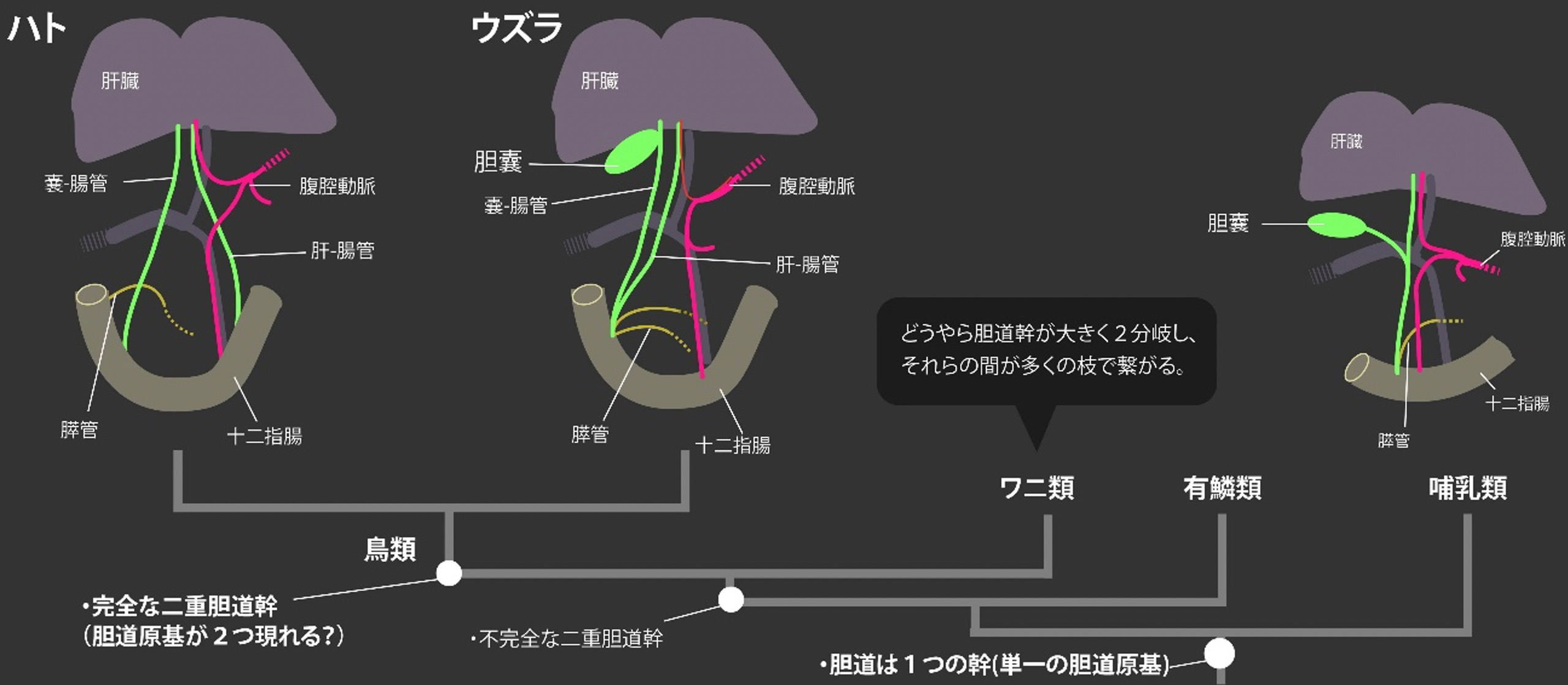
無胆嚢のハトの肝外胆道系は、ウズラと同様に 嚢-腸管(cystic-enteric duct)と肝-腸管(hepatic-enteric duct)という2本の完全に分離した幹 (二重胆道幹) から成ることが明らかとなった(上図)。鳥の祖先型に近い肝・胆・膵管系をもつウズラでは 嚢-腸管の途中に胆嚢が存在する。ウズラにおいては、これら2つの胆管と膵管は十二指腸において一つの開口部を共有していたのに対し、無胆嚢のハトでは2本の胆管幹と膵管は、すべてバラバラの位置で十二指腸に開口していることが判明した。この2つの胆管と膵管の位置関係に両種での顕著な違いが存在するのに対し、肝臓の葉の数や動脈、静脈の位置関係は両者の間でよく保存されていた。
先行研究との比較から、ウズラの肝・胆・膵管系パターンは鳥の祖先的な状態をよく反映しているものと考えられる。一方、ハトと同様に、胆嚢をもたないダチョウの肝外胆管は、ハトと類似した肝・胆・膵管のバラバラの位置関係を持っていることから、この独立した2系統での胆嚢の消失進化は、この大規模な胆管の再編成と密に関連していることが示唆される。この胆嚢の消失に伴ったハトとダチョウの肝外胆管の再編成は、胆嚢の周囲のみがすっぽり抜ける哺乳類の胆嚢欠失の様式とはかなり異なっている点でも非常に興味深く、今後、様々な鳥類や爬虫類の肝・胆・膵管パターンの解析が、鳥類の「二重胆道幹」という独特の構造の成立も含めた脊椎動物の肝外胆管系の進化への理解に重要であろう(Higashiyama & Kanai JVMS, 2021)。
10. SOX17の哺乳動物間の機能多様化の謎を紐解く
基盤A, R6-R10年度 内胚葉決定遺伝子SOX17の哺乳動物間の機能多様化の謎を紐解く!1) 胆囊から肝内胆管まで連続する胆管壁の破綻伝播のメカニズムの解明
ヒト胆道閉鎖症(BA)は、肝門部の胆管の閉塞・破壊により閉塞性黄疸と肝障害を引き起こす。Sox17のヘテロ変異マウスが、胆囊壁の低形成に伴いBAに類似した肝障害を示す。ヒトBAの1/3の症例で、SOX17陽性の胆囊上皮細胞の機能低下が認められ、周産期の胆囊自体の異常が、一部の胆道閉鎖症の原因となっている。しかし、周産期の胆囊壁の異常が、どのように肝傷害を引き起こすのかは不明であった。
本研究は、新規の子宮内胎子の順向性の胆道造影法を用いて、Sox17ヘテロ変異マウスの胆囊壁の低形成による胆汁うっ滞部位の可視化と胆汁の流れを定量的に解析した。その結果、1)Sox17+/-胎子において肝病変が重篤な個体ほど、肝辺縁部で胆汁うっ滞し、胆汁流量が低下すること、2)Sox17+/-胎子の肝門部では、ヒトBAに類似した複数の細い肝管へと細分化し、総肝管の構造が消失すること、3)GFP標識(GFP+)肝内胆管を持つSox17+/- 胎子の解析の結果、細分化した肝管壁には、GFP+肝内胆管が相補的に移動し、肝実質の境界部では、GFP+肝内胆管が肝外まで引き出されること(下図、右)、これにより 4)肝小葉内の肝内胆管ネットワークは、肝臓辺縁部では管腔が狭くなり、肝内胆管周囲で肝線維化が進行することが判明した。また、5)ヒトBAのレトロスペクティブ解析では、葛西手術の時点での胆囊幅(胆囊壁の低形成の指標)と肝障害レベルが強い相関を示し、周産期の本病の発症過程において胆囊壁の破綻が肝内胆管の胆汁鬱滞と直接的に関与していることが判明した。
以上の結果から、周産期の肝門部の胆道系は未だ形態形成の途中の段階であり、胆囊から肝管、肝内胆管まで連続した管腔壁は、胆汁分泌開始後はお互いに強く連結し(上皮バリアー)、テンションがかかりながら 肝門部の胆道の形態形成を進行していると想定される。胆囊上皮の低形成は、肝臓の成長に伴い遠位へ牽引されることにより、総肝管を細分岐化し、さらに先の肝内胆管までも部分的に肝外へと誘導され、小葉内の肝内胆管の管腔形成まで異常が波及することが証明された(下図,左)。
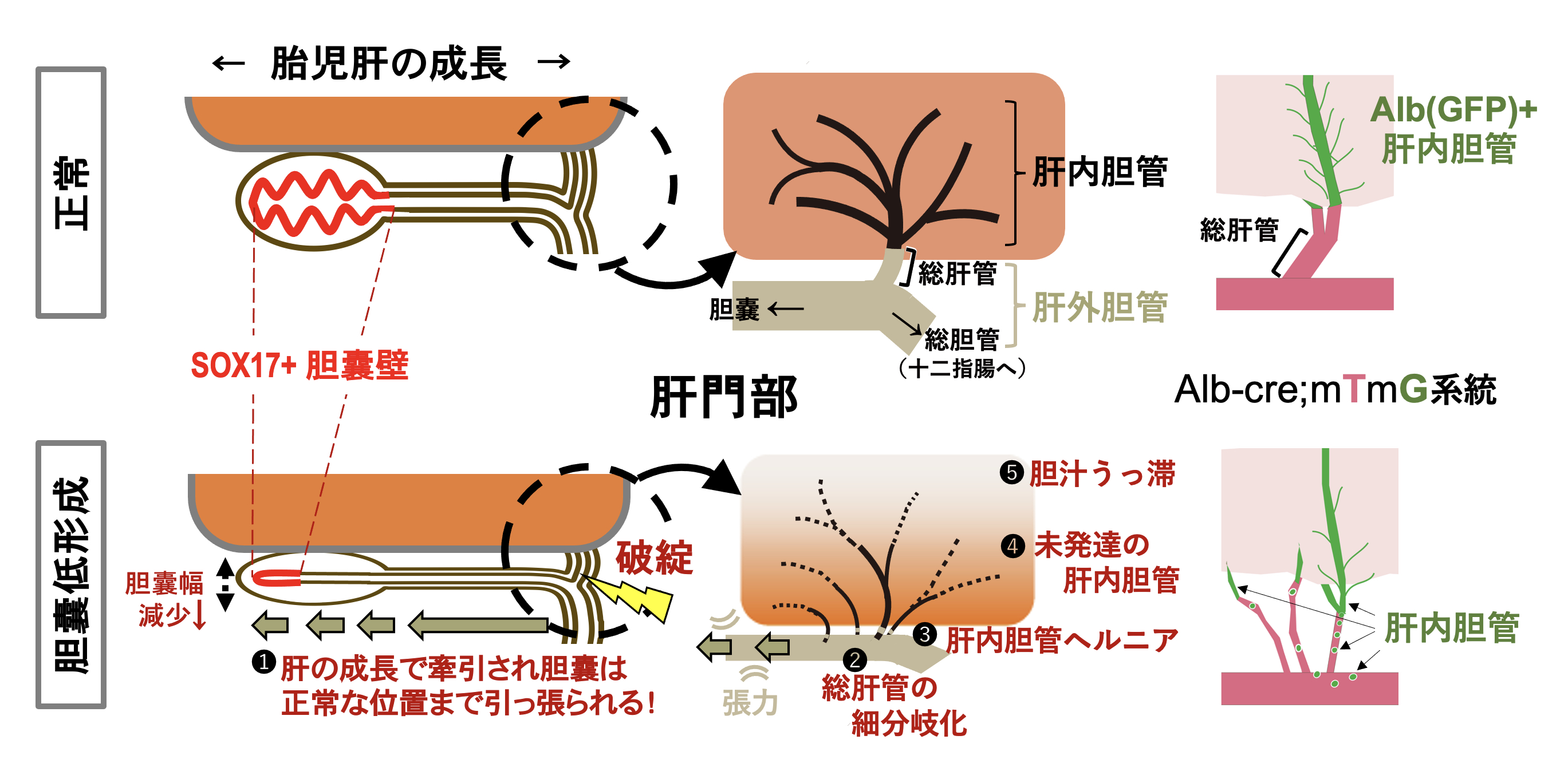
胆囊を持つ動物であるヒツジ、ヤギ、ウシでは、 BAの集団発生が知られる一方、胆囊を持たないウマはその発症例が皆無であり、胆囊の存在自体がBAと深く関連しているものと想定される。本研究は、胆囊壁は肝門部を介して肝内胆管まで管腔上皮を共有していることにより、周産期の胆囊壁の上皮破綻が、肝内胆管まで悪影響が波及するという新しいBA病態を解明した。この胆囊から肝内までの連続する管腔壁の相補性は、 BAの新規の早期診断、治療法の開発へ繋がるものと思われる。 (Miyazaki,Takami et al.Communications Medicine 2024)。
2) 胆囊特異的なSOX17発現維持に寄与するSox17 上流制御領域の発見!
Sox17 は、原始腸管、胆囊、生殖管、血管(特に動脈)などの管腔上皮の形成・維持に重要な機能を担う。Sox17は、胆嚢-胆嚢管形成のマスター制御因子でもあり、Sox17+/-マウスは、そのSox17の半量低下により、胆囊壁の低形成から胆道閉鎖症を発症する(新生子致死)。つまり、胆嚢形成には、2コピー分のSox17の発現量が必須であることが判明している。しかし、胆囊特異的にSox17の高発現を維持するメカニズムは未だに不明のままである。本研究はSox17の時空間的な発現制御機序の解明を目的として、Sox17遺伝子近傍の塩基配列を比較し、シス配列候補として遠位プロモター近傍のR1, R2領域を同定した。次に、これらのR1-R2配列を含む1.3kbのdr領域を欠損させた(Sox17Δdr/Δdr)マウス系統を樹立し、本系統での原始腸管、胆囊、生殖管、血管での表現型を解析した。R1-R2配列を含むdr領域を完全に欠失したSox17Δdr/Δdr マウスの各種管腔上皮での核内SOX17発現を定量化した結果、雌雄の生殖管(精巣網、卵管・子宮上皮)、血管内皮でのSOX17発現量には変化が認められず、雌雄とも正常に妊性をもつ成体マウスに成長したことから、このdr領域は生殖管、血管の機能には必須ではないことが判明した。
一方、非常に興味深いことに、Sox17Δdr/Δdr 新生子の胆囊上皮の核内SOX17量は、同腹の野生型の胆囊上皮と比べて半量まで低下していることを見出した(下図)。そこで、E9.5の胆囊原基、E13.5の胎子胆囊でのSOX17発現レベルを、野生型、Sox17 +/-、Sox17Δdr/Δdr の3者間で比較した結果、E9.5胆囊のSOX17発現レベルは、Sox17Δdr/Δdr 胎子では有意な低下は認められないが、E13.5から胆囊上皮でのSOX17発現は有意に低下し、qPCR解析により、Sox17 mRNA量も低下していることが確認された。さらに、Sox17Δdr/Δdr 胆囊上皮において、異所的にSOX9+非胆囊上皮が出現し、一部の細胞質内にDAB-PAS陽性の顆粒を含む粘液分泌様の上皮へと異形成が生じていることも判明した。
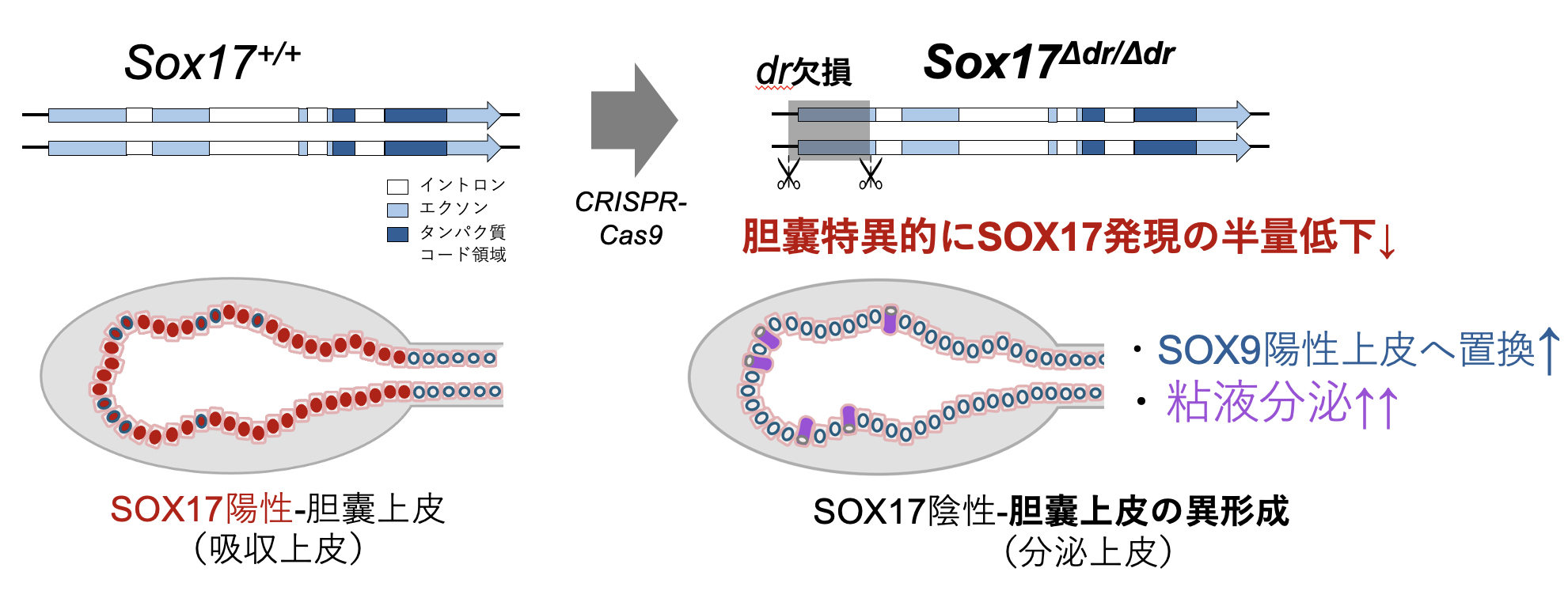
以上の結果から、Sox17上流のdr領域は、胆囊特異的な高発現と正常な胆囊上皮の機能維持に重要な制御領域であり、この領域の欠損により、SOX17発現が半量低下し、肝管上皮様の粘液分泌上皮への異形性が誘導されることが遺伝学的に証明された。このSox17の胆嚢特異的な制御シス配列の同定は、哺乳類で高頻度に起きた「胆嚢の消失進化」を機動する分子基盤の解明への糸口になることが期待される。(Zeng et al., Genes Cells, 2025)。
3) 食用色素ファストグリーンFCFを用いた胆囊・胆管造影法の開発
胆汁うっ滞は、肝臓から十二指腸への胆汁の分泌障害であり、胆道造影は、術前・術後の肝内・外の胆汁の流路の可視性の向上により、そのうっ滞の部位とその原因の診断・治療の手助けとして用いられる。現在、医療現場では、胆管の走行や胆汁動態の可視性を高めるために蛍光胆道造影が広く用いられている。本研究グループは、食用色素であるファストグリーン FCF(以下、FG;通称「緑色3号」)を母体マウスの子宮内胎子への腹腔内投与により、胎子肝での胆汁うっ滞評価ができることを見出していた。しかし、成体マウスでの胆汁動態や、より体の大きいイヌ、ヤギなどの中小動物でのFG胆管造影の有効性は不明であった。
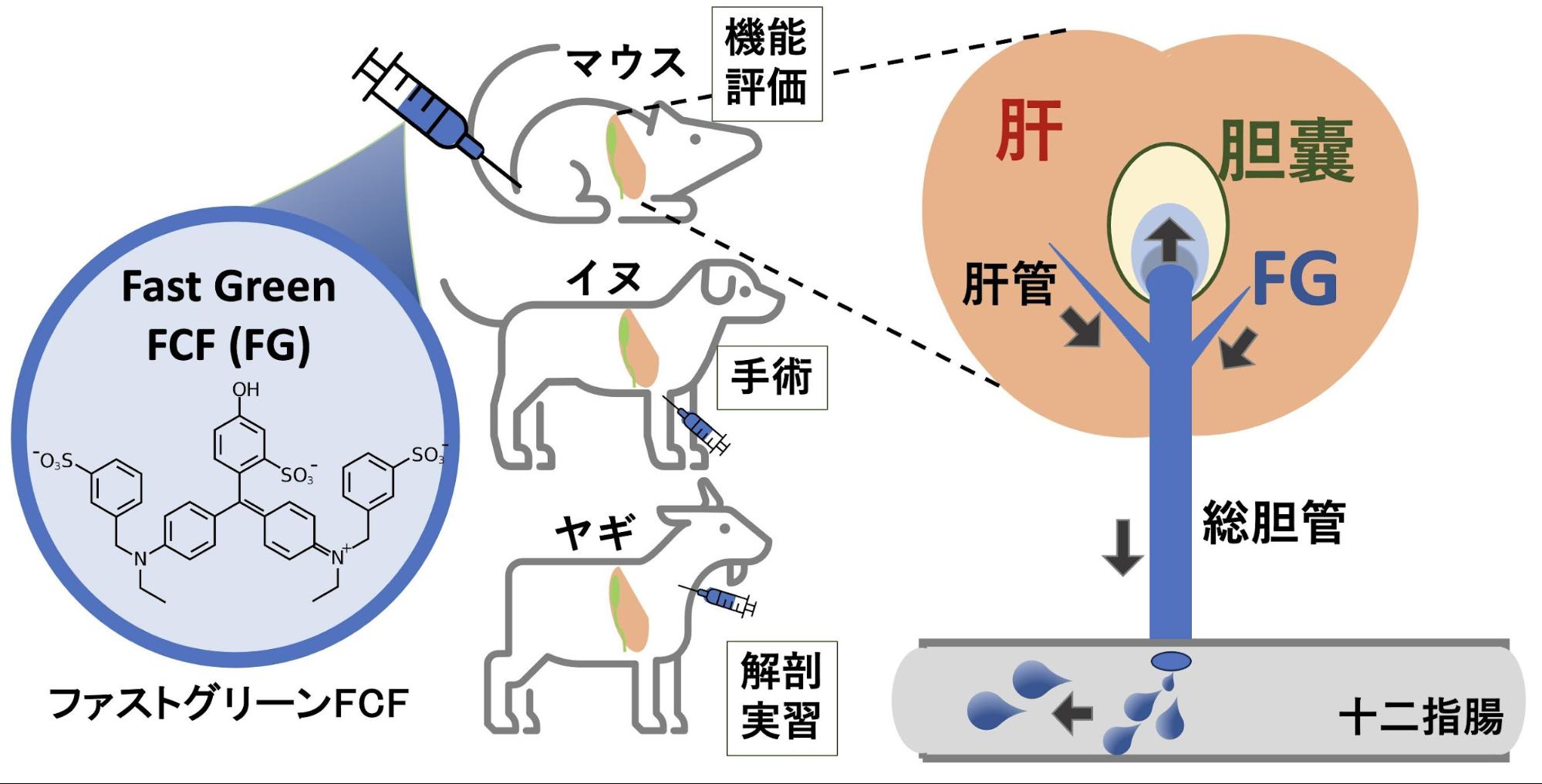
本研究は、イヌ、ヤギでのFG胆管造影により肝外胆管の可視性が向上することを確認した(上図、左)。さらに、成体の胆汁鬱滞性疾患モデルマウスでは、FGにより胆汁の鬱滞部位の同定、胆管壁の構造異常、胆囊内の胆汁の流れを簡便に目視評価することができた(右上動画 [×6倍速])。さらに、12時間絶食した胆囊壁低形成のモデルSox17+/-マウスの胆囊での動画解析により、胆囊胆汁の濃縮異常をFG流入後の拡散パターンの違いで評価できることも判明した。以上の成果から、食品色素を用いた胆道造影は、従来の蛍光造影剤とは異なり目視で胆汁の流れを評価でき、獣医学、医学領域における基礎・臨床研究から動物解剖などの教育実習までの幅広い用途で、簡便なマクロ胆汁評価を可能にする。(Niimi, Miyazaki, Oiki et al., Sci Rep, 2025)。